
- •1.Оксиды
- •2.Основания
- •3.Кислоты
- •11. Электрохимические процессы.Электродные потенциалы.Гальванические элементы.Эдс
- •12.Классификация электродов
- •15. Получение и свойства олова и свинца
- •20.Водород и его соединения
- •21.Вода.Диаграмма состояния воды.
- •31.Коррозия .Классификациякоррозионных процессов
- •32.Химическая коррозия.
- •33.Электрохимическая коррозия.
- •34.Защита металлов от коррозии
- •35.Вычисление ph растворов сильных электролитов
- •36. Вычисление ph растворов слабых электролитов.
- •37.Буферные растворы.Вычисление буферной ёмкости.
- •38.Гетерогенное равновесие: осадок-насыщенный раствор малорастворимого соединения.
- •39.Условие образования и растворения осадка
- •40.Напрвление и глубина протекания окислительно-восстановительной реакции
- •41.Качественные реакции катионов.1 аналитическая группа.
- •47.Качеств. Реак. Анионов. I группа: so42-, co32-, po43-, SiO32-
- •48.Качественные реакции анионов. II группа: ci¯, s2-
- •49. Качественные реакции анионов. III группа: no3¯, MoO42-, wo42-, vo3¯, ch3coo¯
- •50.Количественный анализ . Титриметрический (объемный) анализ
- •51. Жесткость воды. Определение жесткости воды
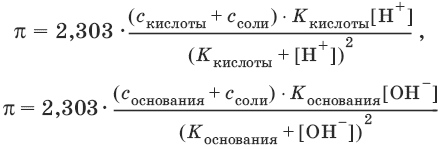
37.Буферные растворы.Вычисление буферной ёмкости.
Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях.
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферныйраствор, формиатный буферный раствор и др.).
Значение pH буферного раствора можно рассчитать по формуле: , где pK это показатель константы диссоциации кислоты HA.
Буферная ёмкость раствора (от англ. buffer — амортизатор, англ. buff — смягчать толчки) — определяет способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+) при условии, что в растворе протекают химические реакции, или при добавлении к раствору электролитов.
Для реакций, скорости которых пропорциональны концентрации соответствующих ионов, это означает поддержание постоянных условий проведения реакции. Емкость буферного раствора определяется количеством сильной кислоты или сильного основания, которое необходимо добавить к 1 л буферного раствора, чтобы изменить его значение рН на единицу.
38.Гетерогенное равновесие: осадок-насыщенный раствор малорастворимого соединения.
Гетерогенное равновесие: осадок – насыщенный раствор малорастворимого соединения. Гетерогенное равновесие между осадком малорастворимого соединения и его ионами в насыщенном водном растворе может быть представлено следующим уравнением:
KtmAnn↓ ↔ mKtn+ + nAnm-
[Ktn+] = m s; [Anm-] = n • s
Константа равновесия обратимой реакции осаждения-растворения называется произведением растворимости Ks

Массу малорастворимого вещества в любом объеме можно рассчитать по формуле:
m(KtmAnn) = s(KtmAnn) • M(KtmAnn) x Vр-ра
39.Условие образования и растворения осадка
Условие образования осадка: малорастворимый электролит выпадает в осадок, когда произведение концентрации ионов становится больше величины ПР электролита, то есть в случае PbI2, когда [Pb2+][I –]2 > ПР(РbI2). Это будет достигнуто путëм прибавления избытка электролита, содержащего ионы Pb2+ или I – -ионы. Растворение осадка будет происходить тогда, когда произведение концентрации ионов станет меньше величины ПР электролита, то есть в случае PbI2, когда [Pb2+][I–]2 < ПР(РbI2). Для хорошо растворимых электролитов значение произведения концентраций ионов в насыщенном растворе может сильно изменяться в присутствии других веществ. Это происходит вследствие изменения коэффициентов активности ионов. Поэтому расчëты, производимые по произведению растворимости без учëта коэффициентов активности, приводят в этих случаях к неверным результатам.
Условие образования и растворения осадка. Осадок не образуется или растворяется, если произведение концентраций ионов осадка в растворе меньше величины произведения растворимости.
[Ktn+]m[Anm-]n < Ks(KtmAnn)
Осадок образуется или выпадает, если произведение концентраций ионов осадка в растворе больше величины произведения растворимости.
[Ktn+]m[Anm-]n > Ks(KtmAnn).
