
Лекция 1
.pdf
vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Реакции обмена в растворах электролитов
Обменные реакции (реакции обмена) – реакции в растворах электролитов, в ходе которых не изменяются степени окисления элементов
Обменные реакции протекают практически необратимо, если в результате образуются малорастворимые, газообразные вещества или слабые электролиты.
Сущность происходящих в растворе процессов выражают ионными уравнениями. В ионных уравнениях учитывают растворимость и относительную степень диссоциации электролитов
При составлении ионных уравнений в виде ионов записывают только растворимые сильные электролиты. Все остальные вещества (неэлектролиты, слабые или малорастворимые электролиты) записывают в молекулярной форме
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Примеры необратимых реакций обмена
Образование малорастворимого вещества (осадка)
Pb(NO ) |
+ 2KI = PbI + 2KNO |
3 |
Pb2+ + 2I- = PbI |
3 2 |
2 |
2 |
|
Образование газообразного вещества |
|
||
Na S + 2HCl = H S + 2NaCl |
S2- + 2H+ = H S |
|
2 |
2 |
2 |
Образование слабых электролитов
CH COONa + HCl = CH COOH + NaCl |
CH COO- + H+ = CH COOH |
||
3 |
3 |
3 |
3 |
Образование соединения, которое распадается на газообразное вещество и слабый электролит
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O CO32- + 2H+ = CO2 + H2O
Образование комплексного соединения
Zn(OH)2 + 2NaOH = Na2 Zn(OH)4 Zn(OH)2 + 2OH- = Zn(OH)4 2-
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Направление реакций обмена
Реакции, в которых исходные вещества и продукты реакции содержат малорастворимые соединения, должны быть обратимыми
AgCl(к) + KI |
AgI(к) + KCl |
ПР |
AgCl |
1,8 10 |
10 |
|
|||
|
|
|
ПР |
AgI |
2,3 10 |
16 |
|
|||
|
|
|
Направление реакции можно определить по значению константы равновесия
AgCl |
+ I- |
AgI |
+ Cl- |
(к) |
|
(к) |
|
Умножаем числитель и знаменатель на Ag+
|
|
|
[Cl |
|
] |
||
K |
|
|
|
|
|||
C |
|
|
|
|
|||
|
|
[I |
] |
|
|||
|
|
|
|
|
|
||
K |
|
|
[Ag ][Cl |
] |
|
ПР AgCl |
|
1,8 10 |
10 |
7,8 105 |
|
C |
|
|
|
|
|
|
|||||
[Ag ][I ] |
|
|
ПР AgI |
2,3 10 16 |
|||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||||
Кс 1  данная реакция практически необратимо протекает в прямом направлении
данная реакция практически необратимо протекает в прямом направлении
AgCl(к) + KI = AgI(к) + KCl
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Определение направления реакции
MnS + 2HCl 
 H2S + MnCl2
H2S + MnCl2
ПР |
MnS |
1,1 10 |
13 |
|
|||
|
|
|
K |
H S |
1,0 10 |
7 |
2 |
|
||
|
|
|
|
|
1 |
|
|
K |
H S |
1,2 10 |
13 |
2 |
|
||
|
|
|
|
|
2 |
|
|
MnS + 2H+ 
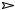 H2S + Mn2+
H2S + Mn2+
После умножения на [S2-] и перегруппировки
|
|
|
[H |
|
|
|
|
2 |
] |
K |
|
|
2 |
S][Mn |
|||||
С |
|
|
|
|
|
|
|||
|
|
|
|
2 |
|
||||
|
|
|
|
[H |
] |
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
2 |
][S |
2 |
] |
|
|
|
[H S] |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
[H S][Mn |
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
|
|
||||||||||||||
K |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
][S |
] |
|
|
|||||||
С |
|
|
|
2 |
|
2 |
|
|
|
|
|
|
|
2 |
|
|
2 |
|
[Mn |
|
|
|
|||||||||||
|
|
|
[H |
[S |
] |
|
|
|
|
|
[H |
|
[S |
] |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
] |
|
|
|
|
|
|
|
|
] |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
KС |
|
ПРMnS |
|
|
|
|
|
1,1 10 |
13 |
|
|
|
9,2 10 |
6 |
|||||||||||||||||
|
|
H2S |
|
H2S |
|
10 |
7 |
1,2 10 |
13 |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
1,0 |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
K1 |
K2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
1 |
|
||
K |
H S |
K |
H S |
|
2 |
2 |
|||
|
|
|||
|
1 |
|
2 |
|
ПРMnS
KC >> 1 – равновесие сильно смещено в сторону прямой реакции, реакция практически необратима MnS + 2HCl = H2S + MnCl2
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Определение направления реакции
CuS + 2HCl 
 H2S + CuCl2
H2S + CuCl2
ПРCuS
KС
6,3 |
10 |
36 |
|||
|
|
||||
|
|
CuS + |
|||
|
|
ПР |
|
|
|
|
|
CuS |
|||
|
H S |
|
H S |
||
|
K |
|
|||
|
2 |
K |
2 |
||
|
|
|
|
||
|
|
1 |
|
|
2 |
K |
H S |
1,0 10 |
7 |
2 |
|
||
|
|
|
|
|
1 |
|
|
2H+ 
 H2S + Cu2+
H2S + Cu2+
|
6,3 10 |
36 |
|
|
|||
|
|
||||||
1,0 10 |
7 |
1,2 10 |
13 |
||||
|
|
||||||
|
|
|
|
||||
K |
H S |
1,2 10 |
13 |
2 |
|
||
|
|
|
|
|
2 |
|
|
5,3 10 |
16 |
|
KC << 1 – равновесие сильно смещено в сторону обратной реакции, которая идет практически необратимо
H2S + CuCl2 = CuS + 2HCl
Реакции, в которых исходные вещества и продукты реакции содержат малорастворимые или слабые электролиты, идут в сторону образования более слабых и менее растворимых электролитов
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Заключение
Константу равновесия в насыщенном растворе малорастворимого сильного электролита между осадком электролита и его ионами в растворе называют произведением растворимости
Обменные реакции (реакциями обмена) - реакции в растворах электролитов, в ходе которых не изменяются степени окисления элементов
Обменные реакции протекают практически необратимо, если в результате образуются малорастворимые, газообразные вещества или слабые электролиты.
Реакции, в которых исходные вещества и продукты реакции содержат малорастворимые или слабые электролиты, идут в сторону образования более слабых и менее растворимых электролитов
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Рекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш. шк.,
1994
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы неорганической химии. Под ред. Ю. Д. Третьякова. - М.: Академия, 2004
Лидин Р.А. Задачи по общей и неорганической химии. - М.: ВЛАДОС, 2004
Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА vk.com/club152685050 | vk.com/id446425943
Лекция 9
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Содержание
Электролитическая диссоциация воды
Ионное произведение воды
Водородный показатель (рН)
Определение рН водных растворов
Буферные растворы
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Диссоциация воды
Упрощенная запись уравнения диссоциации воды :
H2O 
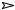 H+ + OH
H+ + OH
Константа диссоциации воды
|
|
|
] |
|
|
16 |
K |
[H |
][OH |
1,8 |
10 |
||
[H O] |
|
|
||||
|
|
|
|
|
||
|
|
2 |
|
|
|
|
при 298 К
При повышении температуры возрастают концентрации ионов H+ и OH
|
T, K |
|
273 |
293 |
298 |
323 |
353 |
373 |
|
|
|
|
|
|
|
|
|
|
|
7 |
0,34 |
0,78 |
1,05 |
2,44 |
5,02 |
7,40 |
([H |
] [OH |
]) 10 |
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
