
Лекция 1
.pdf
vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Степень диссоциации
Степень диссоциации ( ) – отношение количества вещества, распавшегося на ионы, к общему количеству растворенного вещества
Степень диссоциации выражают в долях единицы или в процентах
Степень диссоциации зависит от природы растворенного вещества
ирастворителя, от температуры и концентрации раствора
–наибольшей степенью диссоциации характеризуются вещества с ионной связью
–степень диссоциации растворенного вещества тем выше, чем больше полярность молекул растворителя
–степень диссоциации увеличивается при повышении температуры, при понижении концентрации раствора
Модуль 2. Лекция 7. Свойства растворов электролитов

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
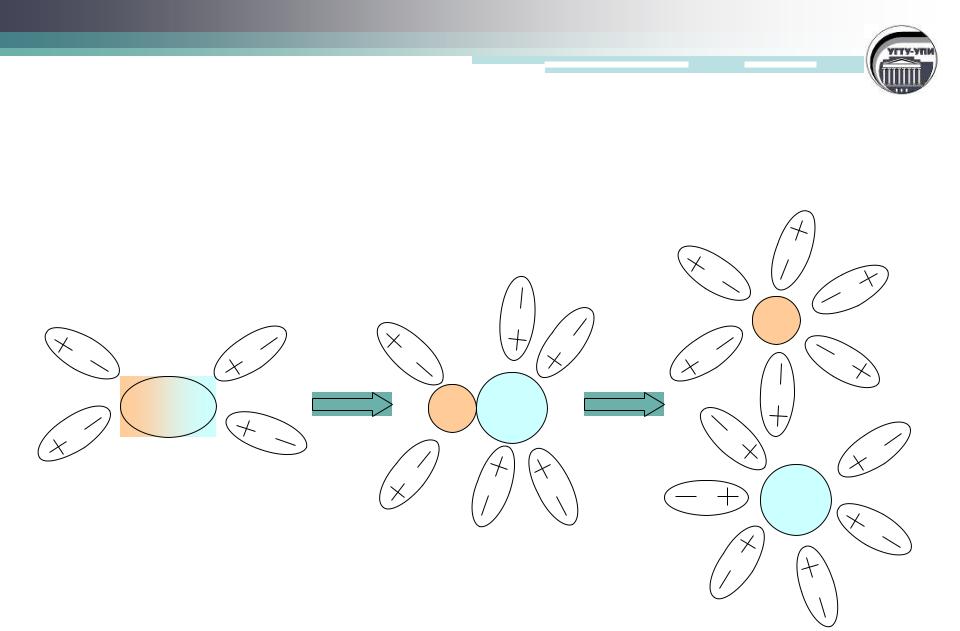
Схема диссоциации NaCl
NaCl + nH2O = Na+(H2O)x + Cl¯(H2O)n-x
Cl¯ |
Na+ |
Cl¯ |
Na+ |
Cl¯ |
Na+
Cl¯ |
Na+ |
Модуль 2. Лекция 7. Свойства растворов электролитов
vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Схема диссоциации полярной молекулы
HCl + nH2O = H+(H2O)x + Cl¯(H2O)n-x
H+
HCl |
H+ Cl¯ |
Cl¯
полярная молекула
гидратированные ионы
Модуль 2. Лекция 7. Свойства растворов электролитов

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Коллигативные свойства растворов электролитов
Относительное понижение давления насыщенного пара растворителя над раствором
p |
0 |
p |
i |
|
|
|
|
|
|
||
|
p |
|
|
||
|
0 |
|
0 |
||
|
|
|
|
Понижение температуры кристаллизации раствора
T |
iK C |
кр |
к m |
Повышение температуры кипения раствора
T |
iK C |
кип |
э m |
Осмотическое давление раствора
pосм iCRT
i - изотонический коэффициент
Модуль 2. Лекция 7. Свойства растворов электролитов

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Изотонический коэффициент (i)
равен отношению числа находящихся в растворе частиц (недиссоциированных молекул и ионов) к общему числу молекул растворенного вещества
Связь изотонического коэффициента со степенью диссоциации Обозначим C – общее число растворенных молекул электролита
αC – число молекул, распавшихся на ионы (C – αC) – число молекул, не распавшихся на ионы
n – число ионов, образующихся при диссоциации nαC – число ионов в растворе
i |
C αC nαC |
1 α nα |
i 1 α(n 1) |
α |
i 1 |
|||
|
|
|
|
|||||
C |
n 1 |
|||||||
|
|
|
|
|||||
Модуль 2. Лекция 7. Свойства растворов электролитов

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Сильные электролиты
Условно – степень диссоциации которых
в0,1М растворе > 30%
Большинство солей
Многие неорганические кислоты:
HNO3, H2SO4, HCl, HBr, HI, HMnO4, HClO4 и
другие
Основания – гидроксиды щелочных и
щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2
Модуль 2. Лекция 7. Свойства растворов электролитов
vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Слабые электролиты
Некоторые неорганические и большинство органических кислот:
H2CO3, H2SiO3, HNO2, H3PO4, H2SO3, H2S, HF, HCN, CH3COOH и другие
Основания (кроме гидроксидов щелочных и щелочноземельных металлов) и амфотерные гидроксиды
Помимо перечисленных, свойства слабых электролитов проявляют также некоторые соли,
например, HgCl2, Fe(NCS)3
Модуль 2. Лекция 7. Свойства растворов электролитов

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Состояние сильных электролитов в водном растворе
Практически полностью диссоциированы на ионы
Al2(SO4)3 = 2Al3+ + 3SO42-
HNO3 = H+ + NO3- |
Ca(OH)2 = Ca2+ + 2OH- |
Взаимодействие ионов в растворе (образование так называемой ионной атмосферы из ионов противоположного заряда, гидратной оболочки из полярных молекул воды)
Изменение свойств раствора в том же направлении, как при уменьшении степени диссоциации
Степень диссоциации можно назвать кажущейся, значения α менее 100 %
Меньше концентрация |
слабее взаимодействие ионов |
α 100% |
|
раствора |
|||
|
|
Модуль 2. Лекция 7. Свойства растворов электролитов

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Диссоциация слабых электролитов. Константа диссоциации
В растворах слабых электролитов – равновесие между ионами и недиссоциированными молекулами:
AB 
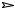 A+ + B-
A+ + B-
Константа равновесия – константа диссоциации (ионизации)
|
[A |
|
][B |
|
] |
K |
|
|
|||
[AB] |
|
|
|||
|
|
|
|||
Константа диссоциации
зависит |
не зависит |
от природы растворенного |
от концентрации раствора |
вещества и растворителя, |
|
от температуры |
|
Значения К слабых электролитов при 298 К – в справочных таблицах Слабее электролит  меньше значение К
меньше значение К
Модуль 2. Лекция 7. Свойства растворов электролитов

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Закон разбавления Оствальда
– взаимосвязь между константой и степенью диссоциации слабого электролита
AB 
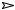 A+ + B-
A+ + B-
Если С – молярная концентрация раствора слабого электролита АВ
|
|
|
αС – концентрация молекул, распавшихся на ионы |
|
[AB] C αC C(1 α) – равновесная концентрация |
||||
|
|
|
|
недиссоциированных молекул |
[A |
|
] [B |
|
] αC – равновесные концентрации ионов |
|
|
|||
|
[A |
|
|
] |
|
αC αC |
|
|
2 |
K |
|
][B |
|
|
αC |
||||
[AB] |
|
C(1 α) |
1 |
α |
|||||
|
|
|
|
||||||
|
|
2 |
|
K |
αC |
||
1 |
α |
||
|
|||
математическое выражение закона разбавления Оствальда
Если
α 1
2 |
α |
K |
|
|
|
|
|
||
K αC |
|
C |
|
|
|
|
|
|
|
α увеличивается с уменьшением концентрации раствора 
Модуль 2. Лекция 7. Свойства растворов электролитов
