
Лекция 1
.pdf
vk.com/club152685050 | vk.com/id446425943
► Изобарический процесс – процесс,
происходящий в физической системе при постоянном давлении (P = const).
V |
T |
const при P const |
|
|
- закон ГейЛюссака
Q U А
vk.com/club152685050 | vk.com/id446425943
► Изобарический процесс – процесс,
происходящий в физической системе при постоянном давлении (P = const).
V |
T |
const при P const |
|
|
- закон ГейЛюссака
Q U А

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Стандартные условия
Все вещества, участвующие в реакции, чистые
Температура 298 К
Парциальные давления газов или атмосферное давление, если газы не участвуют в реакции, равно
1,013∙105 Па
Концентрации частиц в растворах равны 1 моль/л
Примеры обозначения стандартных величин:
H0 298
или
H0
;
S0 298
или S0
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Термохимические уравнения -
уравнения химических реакций, записанные с указанием значения энтальпии H (кДж) и агрегатного состояния участвующих в реакции веществ
H < 0 - экзотермическая реакция (выделение теплоты)
N2(г) + 3H2(г) = 2NH3(г), H0 = - 92 кДж
H > 0 - эндотермическая реакция (поглощение теплоты)
CaCO3(т) = CaO(т) + CO2(г), H0 = 178 кДж
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Энтальпия образования -
энтальпия реакции образования одного моля данного вещества из простых веществ, устойчивых в стандартных условиях
Энтальпии образования простых веществ равны нулю
Пример:
1/2N2(г) + 3/2H2(г) = NH3(г), H0 = - 46 кДж/моль = H0NH3(г)
Энтальпия сгорания -
энтальпия реакции сгорания в кислороде одного моля данного вещества с образованием высших оксидов составляющих его элементов
Пример: |
|
|
С2H5OH(ж) + 3O2(г) = 2СО2(г) + 3H2O(г) , H0 = - 1235 кДж = |
H0сг.С H OH |
|
|
2 |
5 |
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
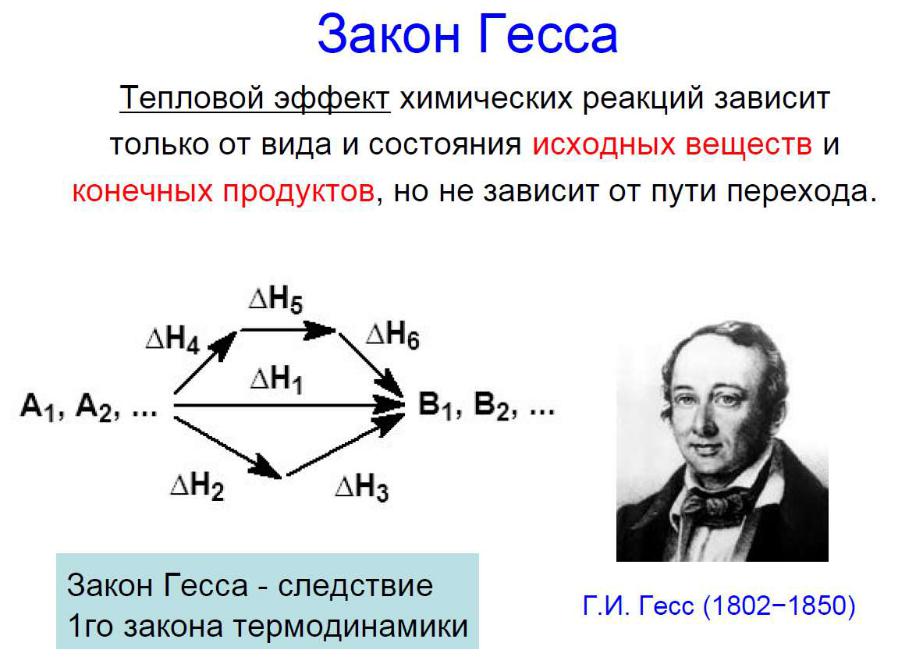
Закон Гесса
энтальпии реакций, протекающих при постоянном давлении или при постоянном объеме, не зависят от пути протекания процесса, а определяются лишь начальным и конечным состояниями системы
|
|
0 |
|
Пример: |
Fe(к) |
Н |
Fe2O3(к) |
1 |
I путь: II путь:
0 |
|
Н |
FeO(к) |
2 |
2Fe(к) + 3/2 O2(г) = Fe2O3(к),
2Fe(к) + O2(г) = 2FeO(к),
2FeO(к) + 1/2O2(г) = Fe2O3(к),
0
Н
3
Н10 821кДж
Н
0 527 кДж
2
0 294 кДж Н 3
0 |
0 |
0 |
294 |
821кДж |
Н |
Н |
Н 527 |
||
1 |
2 |
3 |
|
|
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
vk.com/club152685050 | vk.com/id446425943
vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
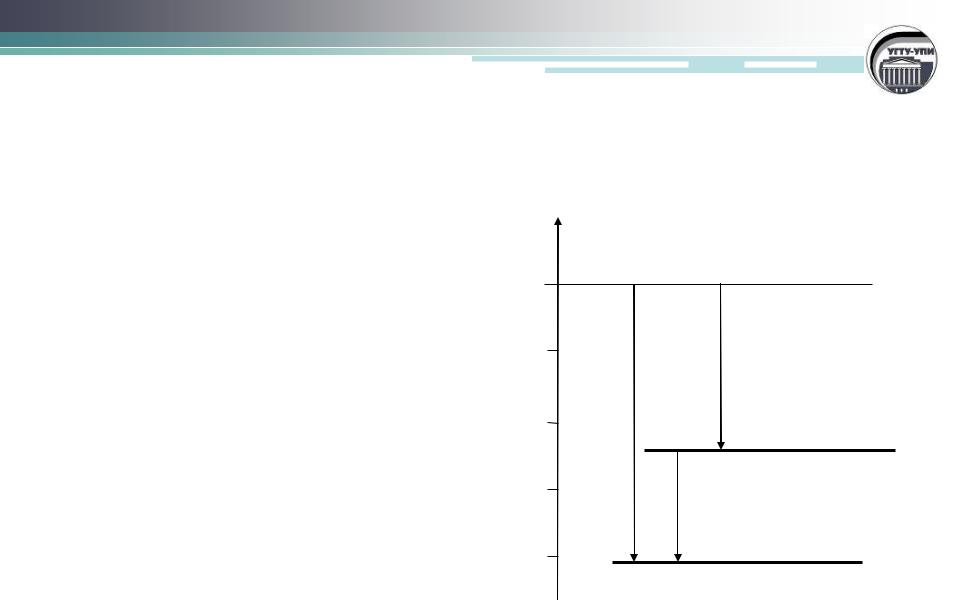
Энтальпийные диаграммы реакций
0 |
, кДж |
Н |
2Fe(к) + 3/2 O2(г) = Fe2O3(к), |
0 |
||
0 |
821кДж |
|
|
Н |
|
||
1 |
|
-200 |
|
|
|
||
2Fe(к) + O2(г) = 2FeO(к), |
-400 |
||
Н0 |
527 кДж |
||
|
|||
2 |
|
|
|
|
|
-600 |
|
2FeO(к) + 1/2O2(г) = Fe2O3(к), |
|
||
Н0 |
294 кДж |
-800 |
|
|
|||
3 |
|
|
|
2Fe(к) + 3/2O2(г)
|
0 |
|
Н |
|
2 |
Н0 |
2FeO(к) + 1/2O2(г) |
|
|
1 |
|
|
0 |
|
Н |
|
3 |
Fe2O3(к)
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Расчет стандартной энтальпии реакции
|
FeO(к) + H2(г) = Fe(к) + H2O(г) |
(1) |
||
по известным термохимическим уравнениям |
|
|
||
|
FeO(к) + СO(г) = Fe(к) + CO2(г), |
0 |
18,2 кДж |
|
|
ΔH |
|||
(2) |
|
|
2 |
|
|
|
0 |
483,6 кДж |
|
|
|
|
ΔH |
|
|
2H2(г) + O2(г) = 2H2O(г), |
3 |
|
|
|
0 |
566 кДж |
||
|
|
|
ΔH |
|
|
2CO(г) + O2(г) = 2CO2(г), |
4 |
|
|
|
|
|
||
Согласно закону Гесса |
(1) = (2) + 1/2 (3) - 1/2(4) |
|||
|
FeO(к) + СO(г) = Fe(к) + CO2(г) |
|
|
|
|
|
|
||
|
H2(г) |
+ 1/2O2(г) = H2O(г) |
|
|
|
|
|
||
(3)
(4)
CO(г) + 1/2O2(г) = CO2(г)
FeO(к)+ СO(г)+ H2(г) + 1/2O2(г) - CO(г) -1/2O2(г) =Fe(к)+ CO2(г)+ H2O(г)- CO2(г)
|
|
|
|
FeO(к) + H2(г) = Fe(к) + H2O(г) |
|||
H0 |
|
H0 |
1/2 |
H0 |
1/2 |
Н0 |
18,2 ( 241,8) ( 283) 23 кДж |
1 |
|
2 |
|
3 |
|
4 |
|
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Закон Гесса. Следствие 1
Энтальпия реакции равна разности сумм энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов
0 |
n |
0 |
обр.прод n |
0 |
Н |
H |
H |
||
|
прод. |
|
исх. |
обр.исх |
Пример.
Стандартная энтальпия реакции
С2H5OH(ж) + 3O2(г) = 2СО2(г) + 3H2O(г)
H0 2 H0 |
3 H0 |
H0 |
|
CO2 |
H2O |
C2H5OH |
|
2( 393,8) 3( 241,8) ( 277,7) 1235,2 кДж.
Модуль I. Лекция 1. Энергетика химических реакций. Основы термохимии
