
Лекция 1
.pdf
vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Содержание
Гетерогенное равновесие в насыщенном растворе малорастворимого сильного электролита. Произведение растворимости
Влияние на растворимость электролита введения одноименных ионов
Условие образования и растворения осадка
Реакции обмена в растворах электролитов
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Произведение растворимости
Гетерогенное равновесие в насыщенном водном растворе малорастворимого сильного электролита
KmAn между осадком электролита и его ионами в растворе
K |
m |
A |
n(к) |
mKn+ + nAm- |
|
|
|
||
осадок |
ионы в растворе |
|||
Константа данного равновесия – произведение растворимости (ПР)
ПР = Kn+ m Am- n
Kn+ m, Am- n – равновесные концентрации ионов, моль/л m и n – стехиометрические коэффициенты
В справочных таблицах приведены значения ПР при Т = 298К (250С)
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Значения ПР малорастворимых электролитов при 250С
В насыщенном растворе сильного малорастворимого электролита произведение равновесных молярных концентраций катионов и анионов в степенях, равных стехиометрическим коэффициентам, при постоянной температуре есть величина постоянная
Для фосфата бария
Ba (PO |
|
|
|
|
|
|
|
|
|
|
3Ba2+ + 2PO |
3- |
|||||
3 4)2(к) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
ПР [Ba |
2 |
|
3 |
[PO |
3 |
] |
2 |
6,0 10 |
39 |
||||||||
] |
|
4 |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для сульфида серебра (I) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ag S |
|
|
|
|
|
|
|
|
|
2Ag+ + S2- |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
2 |
(к) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПР [Ag |
|
] |
2 |
[S |
2 |
] 7,2 10 |
50 |
||||||||||
|
|
|
|
|
|
|
|||||||||||
Меньше значение ПР  меньше растворимость вещества
меньше растворимость вещества
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Расчет растворимости СаСО3
Обозначим S
S
–растворимость карбоната кальция , моль/л
–растворимость карбоната кальция , г/л
Равновесие в насыщенном растворе карбоната кальция СаСО3(к) 
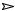 Са2+ + СО32-
Са2+ + СО32-
ПР |
CaCO |
[Ca |
2 |
|
|||
|
3 |
|
|
2 |
|
[Ca |
|
2 |
] |
][CO |
|
3 |
|
|
2 |
] [CO |
|
|
3 |
S |
2 |
|
|
] S
ПР
CaCO |
4,4 10 |
9 |
|
||
3 |
|
|
S |
ПР |
CaCO |
|
4,4 10 |
9 |
6,6 10 |
5 |
|
|
||||||
|
|
3 |
|
|
|
|
|
моль/ л.
Сa2+ = СО32- = 6,6 10 5 моль/л.
Растворимость
S S MCaCO3
|
|
|
|
|
|
|
|
|
|
S |
(г/л) связана с растворимостью S (моль/л) |
|
|
||||||
|
|
|
|||||||
MCaCO3 |
100 г / моль |
|
|
|
|
|
|
|
|
|
|
|
6,6 10 |
5 |
100 |
6,6 10 |
3 |
г / л |
|
|
|
|
S |
|
|
||||
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Соотношение растворимости и ПР
Для малорастворимого электролита KmAn, растворимость которого S
K |
m |
A |
n(к) |
mKn+ + nAm- |
|
|
|
Концентрации ионов (моль/л)
Kn+ = mS |
Am- = nS |
Произведение растворимости
ПР = Kn+ m Am- n = (mS)m(nS)n = mmnnSm+n
Растворимость (моль/л)
S m n ПР
mmnn
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Расчет растворимости Сa3(PO4)2 и Ag2S
Растворимость Сa3(PO4)2 (m = 3, n = 2)
S 3 2 |
ПР |
5 |
ПР |
5 |
2,0 10 |
29 |
7,1 10 |
7 |
|
|||
|
моль/ л |
|||||||||||
|
3 |
|
2 |
108 |
108 |
|
||||||
|
3 |
2 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
Растворимость Ag2S (m = 2, n = 1)
S 2 1 |
ПР |
3 |
ПР |
3 |
7,2 10 |
|
|
2 |
4 |
4 |
|||
|
2 |
|
|
|||
|
|
|
|
|||
50 |
17 |
|
|
2,6 10 |
моль/ л |
||
|
Для однотипных по составу веществ по значениям ПР можно сравнивать растворимость
ПРAg SO |
1,2 10 |
5 |
|
|
|||
2 |
4 |
|
|
>>
ПРAg S 7,2 10 |
50 |
|
|
2 |
|
сульфат серебра (I), растворим значительно лучше, чем сульфид серебра (I)
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Влияние на растворимость электролита введения одноименных ионов
Если в равновесную систему
K A |
m Kn+ |
+ n Am- |
m n(к) |
|
|
|
добавить |
|
сильный электролит KB, |
или |
сильный электролит MA, |
содержащий одноименные |
содержащий одноименные |
|
ионы Kn+ |
|
ионы Am- |
KB = Kn+ + Bn- |
|
MA = Mm+ + Am- |
повышается концентрация ионов Kn+ или Am-
равновесие смещается в сторону образования осадка
Введение в раствор одноименных ионов приводит к уменьшению растворимости электролита
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Расчет растворимости CdCO3
СdСО3(к) 
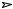 Сd2+ + СО32-
Сd2+ + СО32-
Растворимость карбоната кадмия
ПР |
CdCO |
5,2 10 |
12 |
|
|||
|
3 |
|
|
S |
ПР |
CdCO |
|
5,2 10 |
12 |
2,28 10 |
6 |
моль/ л |
|
|
|||||||
|
|
3 |
|
|
|
|
|
|
Расчет растворимости карбоната кадмия в 0,1М растворе Na2CO3 Концентрация карбонат-ионов
в насыщенном растворе карбоната кадмия
СО32- = S = 2,28 10 6 моль/л
в присутствии карбоната натрия
2 |
2,28 10 |
6 |
0,1 |
0,1моль/ л |
|
[CO |
] |
|
|||
3 |
|
|
|
|
|
Концентрация ионов кадмия в присутствии карбоната натрия
2 |
|
ПР |
CdCO3 |
|
5,2 10 |
12 |
11 |
|
|||
|
5,2 10 |
моль/ л |
|||||||||
[Cd |
] |
|
|
2 |
0,1 |
|
|||||
|
|
|
[CO |
|
|
|
|
||||
|
|
|
|
] |
|
|
|
|
|
||
|
|
|
|
3 |
|
|
|
|
|
|
|
Растворимость карбоната кадмия в 0,1М растворе Na2CO3
S [Cd2 ] 5,2 10 11 моль / л
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Условие выпадения и растворения осадка
Используя значение ПР, можно определить возможность образования или растворения осадка в растворе заданного состава
Произведение молярных концентраций ионов малорастворимого сильного электролита
в заданном |
в насыщенном |
растворе – ПК |
растворе – ПР |
 ПК>ПР – раствор пересыщенный – образуется осадок
ПК>ПР – раствор пересыщенный – образуется осадок  ПК<ПР – раствор ненасыщенный – осадок не образуется
ПК<ПР – раствор ненасыщенный – осадок не образуется
Когда система уже содержит осадок, и создают условия, при которых ПК<ПР (например, разбавляют раствор), осадок частично или полностью растворяется
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

vk.com/club152685050 | vk.com/id446425943ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Определение возможности образования осадка BaSO4
Определите, образуется ли осадок BaSO4 при сливании равных объемов 0,001 М растворов Ba(NO3)2 и Na2SO4
ПРBaSO |
1,1 10 |
10 |
|
|
|
|
|
|
|
|
|
||
4 |
|
|
|
|
|
|
Ba(NO ) |
= Ba2+ + 2NO |
- |
Na SO |
4 |
= 2Na+ + SO 2- |
|
3 2 |
|
|
3 |
2 |
4 |
|
Концентрации ионов
в исходных растворах
C |
2 |
C |
|
) |
|
0,001моль/ л |
Ba |
Ba(NO |
3 |
2 |
|
||
|
|
|
|
CSO24 CNa2SO4 0,001 моль / л
после сливания (V в 2 раза)
в 2 раза)
|
2 |
|
0,001 |
0,0005 моль/ л |
|
||||
C |
|
|||
Ba |
|
|
2 |
|
|
2 |
|
0,001 |
0,0005 |
моль/ л |
|
|
||||||
C |
|
|
||||
|
SO4 |
|
2 |
|
|
|
ПК C |
|
2 |
|
Ba |
|||
|
|
ПК ПРBaSO4
2,5 10-7 1,1 10-10
C |
|
2 |
0,0005 0,0005 2,5 10 |
7 |
|
|
|||
|
SO |
|
|
|
|
|
4 |
|
|
осадок сульфата бария образуется
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
