
- •О. А. Голубчиков
- •Органический практикум
- •Санкт-Петербург
- •Нии химии сПбГу – 2012
- •Оглавление
- •Предисловие
- •1. Общие правила и методы работы
- •1.1. Планирование работ и ведение рабочего журнала
- •1.1.1. Форма ведения записей в лабораторном журнале
- •1.1.2. Пояснения к составлению таблиц
- •1.1.3. План экспериментальной работы. Отчет о выполнении работы
- •1.2. Правила техники безопасности в лаборатории органического синтеза
- •1.2.1. Общие правила работы
- •1.2.2. Правила обращения с ядовитыми и едкими веществами
- •1.2.3. Правила при работе с огнеопасными веществами
- •1.2.4. Правила при работах, которые могут сопровождаться взрывами или выбросами веществ
- •1.2.5. Правила обращения со стеклом
- •1.3. Основные методы выделения и очистки органических соединений
- •1.3.1 Перекристаллизация Принцип метода
- •Подбор растворителя
- •Практика проведения перекристаллизации
- •Обесцвечивание горячих насыщенных растворов
- •Фильтрование с отсасыванием
- •Сушка органических веществ
- •Определение температуры плавления вещества
- •Контрольные вопросы
- •1.3.2. Перегонка органических жидкостей
- •1.3.2. Простая перегонка при атмосферном давлении
- •Перегонка при уменьшенном давлении (под вакуумом)
- •Перегонка с водяным паром
- •Фракционная перегонка и перегонка с дефлегматором
- •Контрольные вопросы
- •1.3.3. Хроматография
- •Газо-жидкостная хроматография
- •Тонкослойная и бумажная хроматография
- •Нуклеофильное замещение у sp3-гибридизованного атома углерода
- •Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
- •Контрольные вопросы
- •2.1.2. Бромистый изопропил
- •Примечания:
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.3. Ацетанилид (метод а)
- •2.1.4. Ацетанилид (метод б)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.5. Ацетилсалициловая кислота (аспирин)
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •2.2. Электрофильное замещение в ароматическом ряду
- •2.2.1. Основные теоретические положения
- •2.2.2. Нитротолуолы (смесь изомеров)
- •Хроматографическое определение изомерного состава нитротолуолов
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.2.4. Cульфаниловая кислота
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.3. Восстановление нитросоединений
- •2.3.1. Основные теоретические положения
- •Восстановление металлами в присутствии растворов электролитов
- •Восстановление в кислой среде металлами
- •Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
- •Восстановление в щелочной среде
- •Восстановление в щелочной среде растворами сульфидов. Селективное восстановление полинитросоединений
- •Определение конца реакции
- •Выделение продуктов реакции
- •Меры предосторожности при работе с ароматическими аминами
- •2.3.2. Анилин
- •Выделение анилина из реакционной смеси
- •2.3.3. Выделение и идентификация аминов
- •Пояснения к синтезу
- •Экстракция органических веществ из водных растворов
- •Контрольные вопросы
- •2.3.4. Мета-Нитроанилин
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4. Получение и превращения диазосоединений
- •2.4.1. Основные теоретические положения
- •Получение ароматических диазосоединений
- •Механизм диазотирования
- •Факторы, влияющие на скорость диазотирования
- •Контроль диазотирования
- •Формы диазосоединений
- •Превращения диазосоединений Азосочетание
- •Реакции солей диазония с выделением азота
- •2.4.2. Йодбензол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4.5. Метилоранж
- •Примечания к синтезу
- •Метиловый оранжевый:
- •2.4.6. Кислотный оранжевый (-нафтолоранж)
- •Азосочетание
- •2.4.7. Резорциновый желтый (тропеолин)
- •Азосочетание
- •2.4.8. Спектрофотометрическое определение содержания красителя в растворе
- •2.4.9. Пояснения к синтезам азокрасителей
- •Контрольные вопросы
- •2.5. Окисление
- •2.5.1. Основные теоретические положения
- •2.5.2. Бензойная кислота (из толуола)
- •Примечание
- •2.5.3. Бензойная кислота (из бензилового спирта)
- •Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
- •Контрольные вопросы
- •2.5.4. Масляный альдегид (бутаналь)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.5.5. Бензальдегид
- •Пояснения к синтезу
- •Контрольные вопросы
- •3. Синтез гетероциклических соединений
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Бензимидазол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Хинолин (синтез Скраупа)
- •Пояснения к синтезу
- •Фенилизоиндолизин
- •Пояснения к синтезу
- •Фенотиазин
- •Пояснения к синтезу
- •5,10,15,20-Тетрафенилпорфирины
- •5,10,15,20-Тетрафенилпорфирин
- •Пояснения к синтезу
- •Хроматографическая очистка тетрафенилпорфирина
- •5,10,15, 20-Тетракис(4-нитрофенил)порфирин
- •Пояснения к синтезу
- •5,10,15,20-Тетракис(4-бромфенил)порфирин
- •Приложение
- •Список рекомендуемой литературы
2.5.2. Бензойная кислота (из толуола)
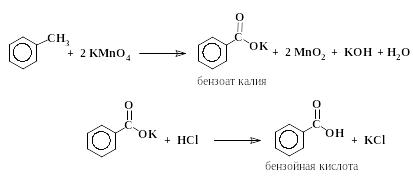
В круглодонной колбе емкостью 150 – 200 мл, снабженной обратным холодильником и мешалкой, нагревают на кипящей водяной бане 1 г толуола и 3,4 г перманганата калия в 75 мл воды. Нагревание продолжают в течение 4 час до исчезновения малиновой окраски (примечание). Выпавшую двуокись марганца отфильтровывают на воронке Бюхнера и дважды промывают кипящей водой порциями по 10 – 15 мл. Фильтраты соединяют, упаривают на кипящей водяной бане до объема 10 – 15 мл и осаждают бензойную кислоту из раствора соляной кислотой, прибавляя ее по каплям. Выпавшую бензойную кислоту отфильтровывают на воронке Бюхнера, промывают небольшим количеством ледяной воды, высушивают и определяют температуру плавления. Выход: 1 г, Тпл 121 С.
Примечание
Если после 4-часового нагревания обесцвечивание раствора не произойдет, к реакционной смеси добавляют раствор бисульфита или сульфита натрия до исчезновения окраски перманганата калия.
2.5.3. Бензойная кислота (из бензилового спирта)
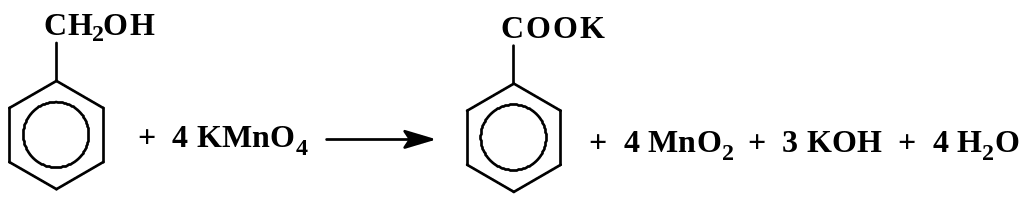

В круглодонную колбу емкостью 150 – 200 мл, снабженную обратным холодильником, помещают 100 мл воды, 4,5 г перманганата калия и 2 мл бензилового спирта. В колбу вносят несколько небольших осколков фарфора. Смесь доводят до слабого кипения и кипятят до тех пор, пока в дистилляте, стекающем в колбу из обратного холодильника, перестанут быть заметны маслянистые капельки неокисленного бензилового спирта (30 – 90 мин.) От непрореагировавшего перманганата избавляются, добавляя в реакционную смесь небольшое количество сульфита или бисульфита натрия, или этилового спирта.
Черный осадок диоксида марганца отфильтровывают на воронке Бюхнера, дважды промывают его 5 – 10 мл кипящей воды и хорошо отжимают. Фильтрат вместе с промывными водами переносят в фарфоровую чашку и упаривают раствор на водяной бане до 25 – 30 мл. К охлажденному упаренному раствору прибавляют соляную кислоту до кислой реакции по индикаторной бумажке. Выпавшую бензойную кислоту отфильтровывают на воронке Бюхнера и промывают на фильтре 10 – 15 мл ледяной воды. Осадок, не высушивая, перекристаллизовывают из кипящей воды. Выход 80 %, Тпл 121 С.
Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
Конец реакции окисления определяют по исчезновению малиновой окраски перманганата калия. Для этого каплю реакционной смеси наносят на фильтровальную бумагу. Если весь перманганат прореагировал, в месте нанесения капли остается черное пятно МnО2, а растекающийся водный раствор бесцветен. Такую пробу можно проводить только в том случае, если перманганат заведомо взят в некотором недостатке по отношению к окисляемому веществу. В противном случае можно контролировать присутствие окисляемого вещества в парах, выходящих из реакционной колбы, и прекращать реакцию, как только оно в них исчезнет. Так поступают, например, при получении бензойной кислоты из бензилового спирта. Избыток перманганата удаляют, добавляя в реакционную смесь какой-либо восстановитель: сульфит или бисульфит натрия, этиловый спирт, формальдегид и т.п. Например,
2
KMnO4
+ 3 C2H5OH![]() 3
CH3CHO
+ 2 MnO2
+ 2 KOH + 2 H2O
3
CH3CHO
+ 2 MnO2
+ 2 KOH + 2 H2O
этиловый спирт ацетальдегид
Образующийся при окислении этилового спирта уксусный альдегид не загрязняет основной продукт – бензойную кислоту, так как, имея низкую температуру кипения, улетает из реакционной смеси.
На примере последней реакции можно показать, как обычно уравниваются органические реакции окисления-восстановления.
2 KMnO4 2 MnO2 + 2 KOH + 3 O |
(1) |
CH3CH2OH + O CH3CHO + H2O |
(2) |
Полуреакция (1) отражает процесс восстановления перманганата в щелочной среде. Полуреакция (2) – процесс окисления спирта до альдегида. Умножая стехиометрические коэффициенты полуреакции (2) на три и складывая после этого уравнения (2) и (1), получают полное уравнение окисления этанола.
При проведении синтеза бензойной кислоты требуется энергичное перемешивание. По мере прохождения реакции выпадает тяжелый осадок диоксида марганца, поэтому даже при незначительных перегревах наблюдаются толчки неравномерно кипящей смеси, что может привести к растрескиванию реакционного сосуда. Чтобы избежать этого, целесообразно перед началом синтеза в колбу положить “кипелки”, например, осколки фарфора.
Следует иметь в виду, что продуктом окисления как толуола, так и бензилового спирта перманганатом калия является не свободная бензойная кислота, а ее калиевая соль, растворенная в воде. Свободную кислоту выделяют путем подкисления водного раствора калиевой соли. Малорастворимая в холодной воде бензойная кислота выпадает в осадок. Необходимо учитывать, что соляная кислота расходуется также и на нейтрализацию образовавшейся в ходе реакции щелочи. При расчете количества соляной кислоты, необходимой для нейтрализации щелочи и превращения бензоата калия в свободную бензойную кислоту, можно руководствоваться правилом: количество эквивалентов кислоты должно быть равно количеству молей взятого KMnO4.
