
- •О. А. Голубчиков
- •Органический практикум
- •Санкт-Петербург
- •Нии химии сПбГу – 2012
- •Оглавление
- •Предисловие
- •1. Общие правила и методы работы
- •1.1. Планирование работ и ведение рабочего журнала
- •1.1.1. Форма ведения записей в лабораторном журнале
- •1.1.2. Пояснения к составлению таблиц
- •1.1.3. План экспериментальной работы. Отчет о выполнении работы
- •1.2. Правила техники безопасности в лаборатории органического синтеза
- •1.2.1. Общие правила работы
- •1.2.2. Правила обращения с ядовитыми и едкими веществами
- •1.2.3. Правила при работе с огнеопасными веществами
- •1.2.4. Правила при работах, которые могут сопровождаться взрывами или выбросами веществ
- •1.2.5. Правила обращения со стеклом
- •1.3. Основные методы выделения и очистки органических соединений
- •1.3.1 Перекристаллизация Принцип метода
- •Подбор растворителя
- •Практика проведения перекристаллизации
- •Обесцвечивание горячих насыщенных растворов
- •Фильтрование с отсасыванием
- •Сушка органических веществ
- •Определение температуры плавления вещества
- •Контрольные вопросы
- •1.3.2. Перегонка органических жидкостей
- •1.3.2. Простая перегонка при атмосферном давлении
- •Перегонка при уменьшенном давлении (под вакуумом)
- •Перегонка с водяным паром
- •Фракционная перегонка и перегонка с дефлегматором
- •Контрольные вопросы
- •1.3.3. Хроматография
- •Газо-жидкостная хроматография
- •Тонкослойная и бумажная хроматография
- •Нуклеофильное замещение у sp3-гибридизованного атома углерода
- •Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
- •Контрольные вопросы
- •2.1.2. Бромистый изопропил
- •Примечания:
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.3. Ацетанилид (метод а)
- •2.1.4. Ацетанилид (метод б)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.5. Ацетилсалициловая кислота (аспирин)
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •2.2. Электрофильное замещение в ароматическом ряду
- •2.2.1. Основные теоретические положения
- •2.2.2. Нитротолуолы (смесь изомеров)
- •Хроматографическое определение изомерного состава нитротолуолов
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.2.4. Cульфаниловая кислота
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.3. Восстановление нитросоединений
- •2.3.1. Основные теоретические положения
- •Восстановление металлами в присутствии растворов электролитов
- •Восстановление в кислой среде металлами
- •Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
- •Восстановление в щелочной среде
- •Восстановление в щелочной среде растворами сульфидов. Селективное восстановление полинитросоединений
- •Определение конца реакции
- •Выделение продуктов реакции
- •Меры предосторожности при работе с ароматическими аминами
- •2.3.2. Анилин
- •Выделение анилина из реакционной смеси
- •2.3.3. Выделение и идентификация аминов
- •Пояснения к синтезу
- •Экстракция органических веществ из водных растворов
- •Контрольные вопросы
- •2.3.4. Мета-Нитроанилин
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4. Получение и превращения диазосоединений
- •2.4.1. Основные теоретические положения
- •Получение ароматических диазосоединений
- •Механизм диазотирования
- •Факторы, влияющие на скорость диазотирования
- •Контроль диазотирования
- •Формы диазосоединений
- •Превращения диазосоединений Азосочетание
- •Реакции солей диазония с выделением азота
- •2.4.2. Йодбензол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4.5. Метилоранж
- •Примечания к синтезу
- •Метиловый оранжевый:
- •2.4.6. Кислотный оранжевый (-нафтолоранж)
- •Азосочетание
- •2.4.7. Резорциновый желтый (тропеолин)
- •Азосочетание
- •2.4.8. Спектрофотометрическое определение содержания красителя в растворе
- •2.4.9. Пояснения к синтезам азокрасителей
- •Контрольные вопросы
- •2.5. Окисление
- •2.5.1. Основные теоретические положения
- •2.5.2. Бензойная кислота (из толуола)
- •Примечание
- •2.5.3. Бензойная кислота (из бензилового спирта)
- •Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
- •Контрольные вопросы
- •2.5.4. Масляный альдегид (бутаналь)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.5.5. Бензальдегид
- •Пояснения к синтезу
- •Контрольные вопросы
- •3. Синтез гетероциклических соединений
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Бензимидазол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Хинолин (синтез Скраупа)
- •Пояснения к синтезу
- •Фенилизоиндолизин
- •Пояснения к синтезу
- •Фенотиазин
- •Пояснения к синтезу
- •5,10,15,20-Тетрафенилпорфирины
- •5,10,15,20-Тетрафенилпорфирин
- •Пояснения к синтезу
- •Хроматографическая очистка тетрафенилпорфирина
- •5,10,15, 20-Тетракис(4-нитрофенил)порфирин
- •Пояснения к синтезу
- •5,10,15,20-Тетракис(4-бромфенил)порфирин
- •Приложение
- •Список рекомендуемой литературы
Механизм диазотирования
Выявлено несколько частиц, способных осуществлять первоначальную атаку аминогруппы. Неионизированная молекула азотистой кислоты НОNО является одной из них, однако, наименее энергичной.
В совместных растворах ой и соляной кислот существуют следующие равновесия:
NO2 + H+ HONO |
азотистая кислота, |
HONO + H+ H2ONO+ |
протонированная азотистая кислота, |
H2ONO+ H2O + NO+ |
нитрозокатион, |
NO+ + Cl Cl-NO |
нитрозилхлорид, |
NO+ + NO2 N2O3 |
трехоксид диазота. |
В зависимости от того, какая минеральная кислота применяется для диазотирования и какова ее крепость, изменяются концентрации активных частиц, и та или иная из них становится главной (но не единственной), принимающей участие в реакции.
Реакционная способность отдельных частиц убывает в порядке:
NO+ > H2ONO+ ClNO > N2O3 > HONO
При диазотировании в среде соляной кислоты основным электрофильным реагентом является хлористый нитрозил, а в бромистоводородной кислоте – бромистый нитрозил. Последний образуется в больших концентрациях, чем ClNО, поэтому реакции нитрозирования и диазотирования в бромистоводородной кислоте протекает с большей скоростью.
Самая активная частица – нитрозокатион в ощутимых количествах образуется лишь в концентрированной серной кислоте из нитрозилсерной кислоты:
HOSO2ONO HSO4 + NO+
Использование разбавленной серной кислоты приводит к образованию N2О3.
Механизм диазотирования в солянокислой среде может быть представлен следующим образом:

Факторы, влияющие на скорость диазотирования
Как видно из схемы, лимитирующей стадией в цепи превращений амина в диазосоединение является реакция нитрозирования, т.е. электрофильное замещение водорода в аминогруппе на нитрозогруппу (-NО). В этой реакции амин принимает участие в форме свободного основания, а не в виде соли. Между тем, в водных растворах минеральных кислот ароматические амины образуют соли, и равновесие:
ArNH2 + H3O+ ArNH3+ + H2O
обычно сильно сдвинуто вправо. Однако диазотирование идет только за счет свободного основания ArNH2. Поскольку медленной стадией является реакция электрофильного замещения водорода у азота аминогруппы, скорость диазотирования больше для тех аминов, у которых электронная плотность на атоме азота больше, т.е. выше основность.
Амины, основность которых сильно понижена под действием электроноакцепторных заместителей (например, 2,4-динитроанилин), приходится диазотировать в концентрированной серной кислоте, где, как уже указывалось, действует чрезвычайно активный нитрозокатион. Таким образом, роль кислоты в процессе диазотирования является двоякой. С одной стороны, ее избыток уменьшает концентрацию свободного амина и тем самым замедляет реакцию, а с другой – способствует образованию более энергичного диазотирующего агента. Обычно ускорение, обусловленное увеличением концентрации диазотирующего агента, превосходит то замедление, которое связано с уменьшением концентрации свободного амина.
Необходимость избытка кислоты при диазотировании обусловлена также тем, что в нейтральной среде (в процессе диазотирования кислота расходуется) соль диазония взаимодействует с непрореагировавшим амином; при этом образуются нерастворимые в воде диазоаминосоединения, имеющие вид желтого творожистого осадка:
Ar-N+N·X
+ H2N-Ar![]() Ar-N=N-NH-Ar
+ HX
Ar-N=N-NH-Ar
+ HX
В практике диазотирования берут обычно от 2,5 до 5 моль кислоты на 1 моль амина при теоретически необходимом количестве в 2 моля. Нитрит обычно берут точно в эквимолярном соотношении с амином, так как избыток азотистой кислоты, равно как и недостаток ее, в реакционной смеси приводят к уменьшению выхода получаемого соединения.
Очень важным фактором при диазотировании является температурный режим. Диазосоединения отличаются очень высокой реакционной способностью, поэтому, как правило, процесс проводится при низкой температуре, чаще всего от 0 до +5 С. Диазотирование – экзотермический процесс. При повышении температуры диазосоединения в водной среде разрушаются с выделением азота и замещением диазогруппы на гидроксил:
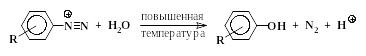
Получающиеся оксисоединения могут дальше вступать в реакцию с диазосоединением; это приводит к загрязненным реакционным смесям.
Присутствие в молекуле амина электроноакцепторных заместителей (R = -NO2, -COOH, -SO3H и т.п.) повышает устойчивость солей диазония и позволяет вести диазотирование при более высокой температуре (до +10 С).
Для поддержания низкой температуры в ходе диазотирования реакционный сосуд обычно охлаждают в смеси снега или размельченного льда с водой. Иногда кусочки льда вносят непосредственно в реакционную смесь.
Скорость реакции диазотирования зависит от растворимости амина: если он растворим, то вследствие гомогенности среды процесс идет быстро; малорастворимые амины диазотируются медленно.
Иногда при диазотировании трудно растворимых аминов изменяют порядок смешивания реагентов. Например, сульфаниловая кислота в кислой среде не растворяется, как не растворяется и ее диазосоединение. В этом случае удобно вводить в минеральную кислоту водный раствор натриевой соли сульфаниловой кислоты в смеси с нитритом натрия:

Реакция диазотирования в этом случае успевает пройти в гомогенной среде при смешивании водных растворов I и II.
Большое значение для ускорения реакции диазотирования имеет интенсивное перемешивание реакционной массы.
