
- •Аналитическое выражение первого начала термодинамики
- •5. Теплоёмкость–количество тепла,которое надо сообщить еденице массы,количества или объема вещества,чтобы его температура повысилась на 1 градус.
- •10. Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре.
- •Дросселирование.
- •Переход через критическую скорость (сопло Лаваля).
- •17. Общая характеристика компрессоров
1. Термодина́мика —соотн и превращ теплоты и других форм энергии.
В термодин имеют дело не с отдельн молек, а с макроскопич телами, состоящ из огромн числа частиц. Эти тела называются термодинамич сист. В термодин тепл явл опис макроскопич величинами — давл, темпер, объём, …, котор не применимы к отдельным молекулам и атомам.
1-й закон — первое начало термодинамики. Представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как δQ = δA + dU, где dU есть полный дифференциал внутренней энергии системы, а δQ и δA есть элементарное количество теплоты, переданное системе, и элементарная работа, совершенная системой соответственно.
2-й закон — второе начало термодинамики: Второй закон термодинамики исключает возможность создания вечного двигателя второго рода. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона. 1 — Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких-либо других изменений в системе. Это явление называют рассеиванием или диссипацией энергии. 2 — Постулат Кельвина. Проц, при котор работа перех в теплоту без каких-либо др измен в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.
3-й закон — третье начало термодинамики: Теорема Нернста: Энтропия любой системы при абсолютном нуле температуры всегда может быть принята равной нулю.
Тепловые процессы:
Адиабатный процесс — происходящий без теплообмена с окружающей средой;
Изохорный процесс — происходящий при постоянном объёме;
Изобарный процесс — происходящий при постоянном давлении;
Изотермический процесс — происходящий при постоянной температуре;
Изоэнтропийный процесс — происходящий при постоянной энтропии;
Изоэнтальпийный процесс — происходящий при постоянной энтальпии;
Политропный процесс — происходящий при постоянной теплоёмкости;
В технике важны круговые процессы (циклы), то есть повторяющиеся процессы, например, цикл Карно, цикл Ренкина.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Свойства идеального газа описываются уравнением Менделеева — Клапейрона
![]()
где
![]() —
давление,
—
давление,
![]() —
концентрация
частиц,
—
концентрация
частиц,
![]() —
постоянная
Больцмана,
—
постоянная
Больцмана,
![]() —
абсолютная температура.
—
абсолютная температура.
Закрытая система–система, в которой количество вещества остаётся постоянным при всех происходящих в ней изменениях.
Закрытые системы делятся на изолированные и неизолированные системы.
Изолированная система – система, у которой нет энергетического взаимодействия с внешней средой.
Гомогенная - система, состоящая из одной фазы вещества или веществ.
Однородная - гомогенная система, неподверженная действию гравитационных, электромагнитных и других сил и имеющая во всех своих частях одинаковые свойства.
Гетерогенная - система, состоящая из нескольких гомогенных частей (фаз), отделенных поверхностью раздела.
Равновесным состоянием системы-состояние системы, которое может существовать сколь угодно долго при отсутствии внешнего воздействия.
Термодинамическая
система – объект
изучения термодинамики – система,
внутреннее состояние которой может
быть описано
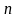 независимых переменных, которые
называются параметрами состояния.
независимых переменных, которые
называются параметрами состояния.
2. Вну́тренняя эне́ргия тела (обозначается как E или U) — полная энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Следовательно, внутренняя энергия складывается из кинетической энергии хаотического движения молекул, потенциальной энергии взаимодействия между ними и внутримолекулярной энергии.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
![]()
Где
![]() —
подведённая к телу теплота,
измеренная в джоулях,
—
подведённая к телу теплота,
измеренная в джоулях,
![]() —
работа,
совершаемая телом против внешних сил,
измеренная в джоулях.
—
работа,
совершаемая телом против внешних сил,
измеренная в джоулях.
Энтальпи́я— термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня с грузом весом Р = p S, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
H = E = U + pV
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии и другим термодинамическим потенциалам — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния
ΔH = H2 − H1
Изменение энтальпии не зависит от пути процесса, определяясь только начальным и конечным состоянием системы. Если система каким-либо путём возвращается в исходное состояние (круговой процесс), то изменение любого её параметра, являющегося функцией состояния, равно нулю, отсюда ΔH = 0
3. Теплота - энергия хаотического движения и взаимодействия частиц тел. Теплота является микрофизической формой передачи энергии от однонго тела к другому при наличии разности температур между ними, причем при этом имеет место обмен кинетической энергией между молекулами соприкасающихся тел, либо перенос тепла электромагнитными волнами.
Работа - макрофизическая форма передачи энергии, связанная с преодолением внешних силовых полей, либо сил давления.
L-механ раб для общ кол-ва в-ва, l-удел механ раб, Q-теплов энерг, q-удел тепл энерг, V-объем, v-удел объем, р-давл среды, д-дельта
Работа расширения
дL=Fdx=pSdx=p(sdx)=pdV
дl=pdv
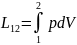
4. Первое начало термодинамики.
Первый закон термодинамики представляют собой закон сохранения и превращения энергии для термодинамических систем. Он устанавливает количественную связь между изменением внутренней энергии системы и внешними воздействиями на нее. Применительно к закрытой термомеханической системе его записывают в виде dU=dQ-dL=dQ-pdV.
Аналитическое выражение первого начала термодинамики
Значения удельных внутренней энергии и энтальпии простого тела однозначно определяются двумя независимыми переменными и могут быть представлены следующим образом:
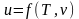 ;
;
 .
.
Изменения внутренней энергии и энтальпии простого тела, как функций состояния, в элементарных процессах являются полными дифференциалами и определяются соотношениями
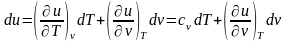 ;
(1)
;
(1)
 .
(2)
.
(2)
Для
изохорного процесса ( )
частная производная внутренней энергии
по температуре равна истинной изохорной
теплоемкости
)
частная производная внутренней энергии
по температуре равна истинной изохорной
теплоемкости
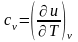 ,
(3)
,
(3)
а
для изобарного процесса ( )
частная производная энтальпии по
температуре равна истинной изобарной
теплоемкости
)
частная производная энтальпии по
температуре равна истинной изобарной
теплоемкости
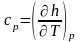 .
(4)
.
(4)
В
результате подстановки выражений (1) и
(2) в уравнение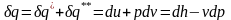 и разделения переменных получим:
и разделения переменных получим:
 .
(5)
.
(5)
Данное соотношение (5) называется первым началом термодинамики для простых тел в аналитической форме.
5. Теплоёмкость–количество тепла,которое надо сообщить еденице массы,количества или объема вещества,чтобы его температура повысилась на 1 градус.
Истинная
теплоемкость: ,
где
,
где
 - какой-то процесс.
- какой-то процесс.
 .
При изохорном процессе
.
При изохорном процессе
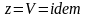 ,
следовательно, получаем изохорную
теплоёмкость -
,
следовательно, получаем изохорную
теплоёмкость -
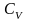 .
При изобарном процессе
.
При изобарном процессе
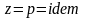 ,
следовательно, получаем изобарную
теплоёмкость
,
следовательно, получаем изобарную
теплоёмкость
 .
.
Объёмная
теплоёмкость
 :
:
Объемная изобарная теплоёмкость -
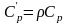 .
.Объёмная изохорная теплоёмкость -
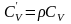 .
.
Молярная
теплоёмкость
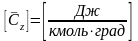 :
:
Молярная изобарная теплоёмкость -
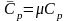 .
.Молярная изохорная теплоёмкость -
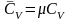 .
.
Средняя
теплоёмкость
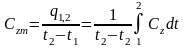 .
.
 -первая
сред.теплоемкость-численно равна
истинной теплоемкоти при
среднеарифм.температуре процесса.
-первая
сред.теплоемкость-численно равна
истинной теплоемкоти при
среднеарифм.температуре процесса.
Ср=Сv+R – уравнение Майера.
6.
Энтропия
 ,
,
 .
.
Удельная
энтропия
 ,
,
 .
.
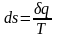
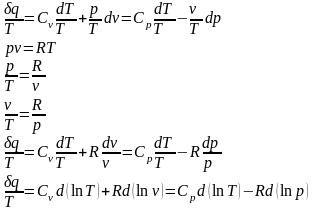
Энтропия, как и время, всё время возрастает. Только в изолированной системе энтропия может оставаться постоянной.
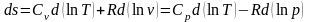
При
давлении
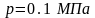 и температуре
и температуре
 удельная энтропия
удельная энтропия
 .
.
 ,
где
,
где
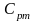 - вторая средняя теплоёмкость или
логарифмическая теплоёмкость.
- вторая средняя теплоёмкость или
логарифмическая теплоёмкость.
Т ак
как
ак
как
 ,
то если энтропия растёт, то есть
,
то если энтропия растёт, то есть
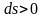 ,
то тепло подводится, то есть
,
то тепло подводится, то есть
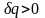 .
.
Уравнение, определяющее энтропию:
7. Политропный процесс — термодинамический процесс, во время которого удельная теплоёмкость c газа остаётся неизменной. Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими.
Для идеального газа уравнение политропы может быть записано в виде:
pVn = const
где
величина
![]() называется
показателем политропы.
называется
показателем политропы.
В зависимости от процесса можно определить значение n:
1. Изотермический процесс: n = 1, так как PV1 = const, значит PV = const, значит T = const.
2. Изобарный процесс: n = 0, так как PV0 = P = const.
3. Адиабатный процесс: n = γ, это следует из уравнения Пуассона.
4.
Изохорный процесс:
![]() ,
так как
,
так как
![]() ,
значит P1
/ P2
= (V2
/ V1)n,
значит V2
/ V1
= (P1
/ P2)(1
/ n),
значит, чтобы V2
/ V1
обратились в 1, n должна быть бесконечность.
,
значит P1
/ P2
= (V2
/ V1)n,
значит V2
/ V1
= (P1
/ P2)(1
/ n),
значит, чтобы V2
/ V1
обратились в 1, n должна быть бесконечность.
8. Работа политропного процесса определяется аналогично как при адиабатном процессе:
l = R·(T1 – T2) / (n – 1); (4.25) l = R·T1·[1 – ( 1/ 2) n-1] /(n – 1); (4.26) l = R·T2·[1 – (P2/P1) (n-1)/ n] /(n – 1). (4.27)
Теплота процесса:
q = cn ·(T2 – T1), (4.28)
где cn = cv ·(n - )/(n – 1) – массовая теплоемкость политропного процесса.

9. Изохорный процесс. (V=const)

Изобарный процесс. (Р=const)

Изохорный процесс — это термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
Из определения работы следует, что изменение работы при изохорном процессе равна:
![]()
Чтобы определить полную работу процесса проинтегрируем данное выражение. Поскольку объем неизменен, то:
![]() ,
,
Но такой интеграл равен нулю. Итак, при изохорном процессе газ работы не совершает:
![]() .
.
Графически доказать это намного проще. С математической точки зрения, работа процесса — это площадь под графиком. Но график изохорного процесса является перпендикуляром к оси абсцисс. Таким образом, площадь под ним равна нулю.
Изменение внутренней энергии идеального газа можно найти по формуле:
![]() ,
,
где i — число степеней свободы, которое зависит от количества атомов в молекуле (3 для одноатомной (например, неон), 5 для двухатомной (например, кислород) и 6 для трёхатомной и более (например, молекула водяного пара)).
Из определения и формулы теплоёмкости и, формулу для внутренней энергии можно переписать в виде:
![]() ,
,
где
![]() —
молярная теплоёмкость при постоянном
объёме.
—
молярная теплоёмкость при постоянном
объёме.
Используя первое начало термодинамики можно найти количество теплоты при изохорном процессе:
![]()
Но при изохорном процессе газ не выполняет работу. То есть, имеет место равенство:
![]() ,
,
то есть вся теплота, которую получает газ идёт на изменение его внутренней энергии.
Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует:
![]()
Выше была выведена формула для определения количества теплоты. Перепишем ее в дифференциальном виде:
![]() ,
,
где ν — количество вещества, — молярная теплоемкостью при постоянном объеме. Итак, микроскопическое изменение энтропии при изохорном процессе можно определить по формуле:
![]()
Или, если проинтегрировать последнее выражение, полное изменение энтропии в этом процессе:

В данном случае выносить выражение молярной теплоемкости при постоянном объеме за знак интеграла нельзя, поскольку она является функцией, которая зависит от температуры.
Изобарный процесс (др.-греч. ισος, isos — «одинаковый» + βαρος, baros — «вес») — термодинамический процесс, происходящий в системе при постоянном давлении.
Согласно
закону
Гей-Люссака,
при изобарном процессе в идеальном
газе
![]() .
.
Работа, совершаемая газом при расширении или сжатии газа, равна A = PΔV.
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: δQ = ΔI = ΔU + PΔV.
Изменение
энтропии
при квазистатическом
изобарном процессе равно
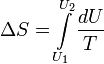 .
В случае, если изобарный процесс
происходит в идеальном газе, то dU
= d(νCvT
+ νRT)
= ν(Cv
+ R)dT
= νCpdT,
следовательно, изменение энтропии можно
выразить как
.
В случае, если изобарный процесс
происходит в идеальном газе, то dU
= d(νCvT
+ νRT)
= ν(Cv
+ R)dT
= νCpdT,
следовательно, изменение энтропии можно
выразить как
 .
Если пренебречь зависимостью Cp
от температуры, то
.
Если пренебречь зависимостью Cp
от температуры, то
![]() .
.
