
- •Неинерциальные системы отсчёта (нисо). Описание движения материальной точки в нисо. Силы инерции: переносная, центробежная и кориолисова.
- •1 Объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
- •Давление идеального газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
- •Коэффициент теплопроводности вакуума
Давление идеального газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
Распределение Ма́ксвелла — распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию. Распределение Максвелла также применимо для электронных процессов переноса и других явлений. Распределение Максвелла применимо к множеству свойств индивидуальных молекул в газе. О нём обычно думают как о распределении энергий молекул в газе, но оно может также применяться к распределению скоростей, импульсов, и модуля импульсов молекул. Также оно может быть выражено как дискретное распределение по множеству дискретных уровней энергии, или как непрерывное распределение по некоторому континууму энергии.
Распределение Максвелла может быть получено при помощи статистической механики (см. происхождение статсуммы). Как распределение энергии, оно соответствует самому вероятному распределению энергии, в столкновительно-доминируемой системе, состоящей из большого количества невзаимодействующих частиц, в которой квантовые эффекты являются незначительными. Так как взаимодействие между молекулами в газе является обычно весьма небольшим, распределение Максвелла даёт довольно хорошее приближение ситуации, существующей в газе.
Во многих других случаях, однако, даже приблизительно не выполнено условие доминирования упругих соударений над всеми другими процессами. Это верно, например, в физикеионосферы и космической плазмы, где процессы рекомбинации и столкновительного возбуждения (то есть излучательные процессы) имеют большое значение, в особенности для электронов. Предположение о применимости распределения Максвелла дало бы в этом случае не только количественно неверные результаты, но даже предотвратило бы правильное понимание физики процессов на качественном уровне. Также, в том случае где квантовая де Бройлева длина волны частиц газа не является малой по сравнению с расстоянием между частицами, будут наблюдаться отклонения от распределения Максвелла из-за квантовых эффектов.
Распределение энергии Максвелла может быть выражено как дискретное распределение энергии:
 ,
,
где ![]() является
числом молекул имеющих энергию
является
числом молекул имеющих энергию ![]() при
температуре системы
,
при
температуре системы
, ![]() является
общим числом молекул в системе
и
является
общим числом молекул в системе
и ![]() — постоянная
Больцмана.
(Отметьте, что иногда вышеупомянутое
уравнение записывается с множителем
— постоянная
Больцмана.
(Отметьте, что иногда вышеупомянутое
уравнение записывается с множителем ![]() ,
обозначающим степень вырождения
энергетических уровней. В этом случае
сумма будет по всем энергиям, а не всем
состояниям системы). Поскольку скорость
связана с энергией, уравнение (1) может
использоваться для получения связи
между температурой и скоростями молекул
в газе. Знаменатель в уравнении (1)
известен как каноническая статистическая
сумма.
,
обозначающим степень вырождения
энергетических уровней. В этом случае
сумма будет по всем энергиям, а не всем
состояниям системы). Поскольку скорость
связана с энергией, уравнение (1) может
использоваться для получения связи
между температурой и скоростями молекул
в газе. Знаменатель в уравнении (1)
известен как каноническая статистическая
сумма.
Барометрическая формула. Распределение Больцмана
При выводе основного уравнения молекулярно-кинетической теории газов и максвелловского распределения молекул по скоростям делалось предположение, что внешние силы не действуют на молекулы газа, поэтому молекулы равномерно распределены по объему. Но молекулы любого газа находятся в потенциальном поле тяготения Земли. Сила тяжести, с одной стороны, и тепловое движение молекул — с другой, приводят газ к некоторому стационарному состоянию, при котором давление газа с высотой уменьшается. Выведем закон изменения давления с высотой, предполагая при этом, что масса всех молекул одинакова, поле тяготения однородно и температура постоянна.
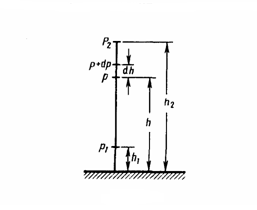 Рис.1
Рис.1
Если
атмосферное давление на высоте h равно
р (рис. 1), то на высоте h+dh оно равно p+dp
(при dh>0 dp<0, так как давление с высотой
уменьшается). Разность давлений р и
p+dp равна весу газа, заключенного в
объеме цилиндра высотой dh с основанием
площадью 1 м2:
![]() где
ρ — плотность газа на высоте h (dh настолько
мало, что при изменении высоты в этом
интервале плотность газа можно считать
постоянной). Значит,
где
ρ — плотность газа на высоте h (dh настолько
мало, что при изменении высоты в этом
интервале плотность газа можно считать
постоянной). Значит,
![]() (1)
Зная
уравнение состояния идеального газа
pV=(m/M) RT (m — масса газа, М — молярная
масса газа), находим, что
(1)
Зная
уравнение состояния идеального газа
pV=(m/M) RT (m — масса газа, М — молярная
масса газа), находим, что
![]() Подставив
это выражение в (1), получим
Подставив
это выражение в (1), получим
![]() или
или ![]() С
изменением высоты от h1 до
h2 давление
изменяется от р1 до
р2 (рис.
67), т. е.
С
изменением высоты от h1 до
h2 давление
изменяется от р1 до
р2 (рис.
67), т. е.
![]() или
или ![]() (2)
Выражение
(2) называется барометрической
формулой.
Она позволяет вычислить атмосферное
давление в зависимости от высоты или,
измеряя давление, найти высоту: Так как
высоты считаются относительно уровня
моря, где давление считается нормальным,
то выражение (2) может быть представлено
в виде
(2)
Выражение
(2) называется барометрической
формулой.
Она позволяет вычислить атмосферное
давление в зависимости от высоты или,
измеряя давление, найти высоту: Так как
высоты считаются относительно уровня
моря, где давление считается нормальным,
то выражение (2) может быть представлено
в виде
![]() (3)
где
р — давление на высоте h.
Прибор
для определения высоты над земной
поверхностью называется высотомером (или альтиметром).
Его работа основана на применении
формулы (3). Из этой формулы следует, что
чем тяжелее газ, тем давление с высотой
убывает тем быстрее.
Барометрическую
формулу (3) можно преобразовать, если
воспользоваться формулой p=nkT:
где
n – концентрация молекул на высоте h,
n0 –
то же, на высоте h=0. Так как M=m0NA (NA –
постоянная Авогадро, m0 –
масса одной молекулы), a R=kNA,
то
(3)
где
р — давление на высоте h.
Прибор
для определения высоты над земной
поверхностью называется высотомером (или альтиметром).
Его работа основана на применении
формулы (3). Из этой формулы следует, что
чем тяжелее газ, тем давление с высотой
убывает тем быстрее.
Барометрическую
формулу (3) можно преобразовать, если
воспользоваться формулой p=nkT:
где
n – концентрация молекул на высоте h,
n0 –
то же, на высоте h=0. Так как M=m0NA (NA –
постоянная Авогадро, m0 –
масса одной молекулы), a R=kNA,
то
![]() (4)
где
m0gh=P
— потенциальная энергия молекулы в
поле тяготения, т. е.
(4)
где
m0gh=P
— потенциальная энергия молекулы в
поле тяготения, т. е.
![]() (5)
Выражение
(5) называется распределением
Больцмана для
внешнего потенциального поля. Из него
видно, что при постоянной температуре
плотность газа больше там, где меньше
потенциальная энергия его молекул.
Если
частицы находятся в состоянии хаотического
теплового движения и имеют одинаковую
массу и , то распределение Больцмана
(5) применимо в любом внешнем потенциальном
поле, а не только в поле сил тяжести.
(5)
Выражение
(5) называется распределением
Больцмана для
внешнего потенциального поля. Из него
видно, что при постоянной температуре
плотность газа больше там, где меньше
потенциальная энергия его молекул.
Если
частицы находятся в состоянии хаотического
теплового движения и имеют одинаковую
массу и , то распределение Больцмана
(5) применимо в любом внешнем потенциальном
поле, а не только в поле сил тяжести.
|
Среднее число столкновений и средняя длина свободного движения молекул.
Молекулы газа, находясь в состоянии хао тического движения, непрерывно сталки ваются друг с другом. Между двумя по следовательными столкновениями молеку лы проходят некоторый путь l, который называется длиной свободного пробега. В общем случае длина пути между по следовательными столкновениями различ на, но так как мы имеем дело с огромным числом молекул и они находятся в бес порядочном движении, то можно говорить о средней длине свободного пробега молекул
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d (рис.68). Он за висит от скорости сталкивающихся моле кул, т. е. от температуры газа (несколько уменьшается с ростом температуры).
Так как за 1 с молекула проходит в среднем путь, равный средней арифметической скорости <v>, и если (z) —сред нее число столкновений, испытываемых одной молекулой газа за 1 с, то средняя длина свободного пробега

<l>=<v>/<z>.
Для определения <z> представим себе молекулу в виде шарика диаметром d, которая движется среди других «застыв ших» молекул. Эта молекула столкнется только с теми молекулами, центры кото рых находятся на расстояниях, рав ных или меньших d, т. е. лежат внутри «ломаного» цилиндра радиусом d.
Среднее число столкновений за 1 с равно числу молекул в объеме «ломано го» цилиндра:
<z>=nV,
где n — концентрация молекул, V = = d2<v> (<v> —средняя скорость мо лекулы или путь, пройденный ею за 1с). Таким образом, среднее число столкновений
<z>=nd2<v>.
Расчеты показывают, что при учете дви жения других молекул
![]()
Тогда средняя длина свободного про бега
![]()
т.е. (l) обратно пропорциональна кон центрации n молекул. С другой стороны, из (42.6) следует, что при постоянной температуре n пропорциональна давлению р.
Следовательно,

Первый закон термодинамики. Работа, теплота, теплоемкость, ее виды.
Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U1, получи ла некоторое количество теплоты Q и, перейдя в новое состояние, характеризую щееся внутренней энергией U2, совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считает ся положительным, когда оно подводится к системе, а работа — положительной, когда система совершает ее против внеш них сил. Опыт показывает, что в соответ ствии с законом сохранения энергии при любом способе перехода системы из перво го состояния во второе изменение внутрен ней энергии U=U2-U1 будет одинако вым и равным разности между количест вом теплоты Q, полученным системой, и работой А, совершенной системой про тив внешних сил:
U=Q-A,
или
Q=U+A. (51.1)
Уравнение (51.1) выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
Выражение (51.1) в дифференциаль ной форме будет иметь вид
dQ=dU+dA,
где dU — бесконечно малое изменение внутренней энергии системы.
Работа
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, на ходящийся под поршнем в цилиндриче ском сосуде (рис. 78). Если газ, расширя ясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу
A=Fdl=pSdl=pdV,
где S — площадь поршня, Sdl=dV— из менение объема системы. Таким образом,
A=pdV. (52.1)
Полную работу A, совершаемую газом при изменении его объема от V1 до V2, найдем
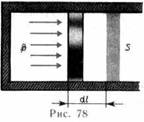
интегрированием формулы (52.1):

Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и га зообразных тел.
Теплота
Теплота - один из двух, известных современному естествознанию, способов передачи энергии - мера передачи неупорядоченного движения. Количество переданной энергии называют количеством теплоты.
а) изохорный процесс (V=const)
б) изобарный процесс (p=const)
в) изотермическом (T=const)
Теплоёмкость тела (обозначается C) — физическая величина, определяющая отношение бесконечно малого количества теплоты ΔQ, полученного телом, к соответствующему приращению его температуры ΔT:
![]()
Единица измерения теплоёмкости в системе СИ — Дж/К.
Удельная теплоемкость вещества ве личина, равная количеству теплоты, не обходимому для нагревания 1 кг вещест ва на 1 К:

Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг•К)).
Молярная теплоемкость— величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
![]()
где v = m/M — количество вещества, вы ражающее число молей.
Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль•К)).
Удельная теплоемкость с связана с мо лярной Сm соотношением
Ст = сМ, (53.2)
где М — молярная масса вещества.
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа). Если речь идёт не о каком-либо теле, а о некотором веществе как таковом, то различают удельную теплоёмкость — теплоёмкость единицы массы этого вещества и молярную — теплоёмкость одного моля его.
Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоёмкость идеального газа с i степенями свободы при постоянном объеме равна:
![]()
А при постоянном давлении
![]()
Вращательное движение - это движение, при котором все точки тела движутся по окружностям, центры которых лежат на одной и той же прямой, называемой осью вращения. Система отсчета - совокупность системы координат и часов, связанных с телом отсчета. Траектория движения материальной точки - линия, описываемая этой точкой в пространстве. Длина участка траектории, пройденного материальной точкой с момента начала отсчета времени, называется длиной пути.
Теплопрово́дность — это перенос тепловой энергии структурными частицами вещества (молекулами, атомами, ионами) в процессе их теплового движения. Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества. Явление теплопроводности заключается в том, что кинетическая энергия атомов и молекул, которая определяет температуру тела, передаётся другому телу при их взаимодействии или передаётся из более нагретых областей тела к менее нагретым областям. Иногда теплопроводностью называется также количественная оценка способности конкретного вещества проводить тепло.
Численная характеристика теплопроводности материала равна количеству теплоты, проходящей через материал толщиной 1 м и площадью 1 кв.м за единицу времени (секунду) при разности температур на двух противоположных поверхностях в 1 К. Данная численная характеристика используется для расчета теплопроводности для калибрования и охлаждения профильных изделий.
Исторически считалось, что передача тепловой энергии связана с перетеканием теплорода от одного тела к другому. Однако более поздние опыты, в частности, нагрев пушечных стволов при сверлении, опровергли реальность существования теплорода как самостоятельного вида материи. Соответственно, в настоящее время считается, что явление теплопроводности обусловлено стремлением занять состояние более близкое к термодинамическому равновесию, что выражается в выравнивании температуры.

 Рис.1
Рис.1 Рис.2
Рис.2