
14. Изотермический процесс.
Уравнение изотермического процесса: Т= const или pv = const.Графически изотермический процесс в р—v-диаграмме изображается в виде равнобокой гиперболы что вытекает из уравнения pv = const, и называется изотермой.
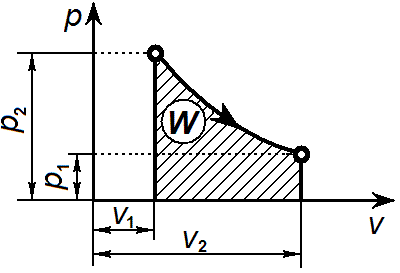
Так как Т1 = Т2, изменение внутренней энергии газа в изотермическом процессе равно нулю:
![]()
Совершенная 1 кг газа работа в изотермическом процессе, c учетом того что RT = const, определяется следующим образом:
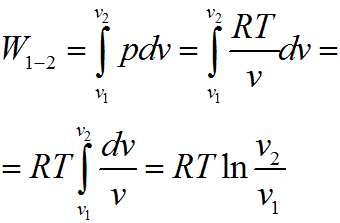
15. Изобарический процесс.
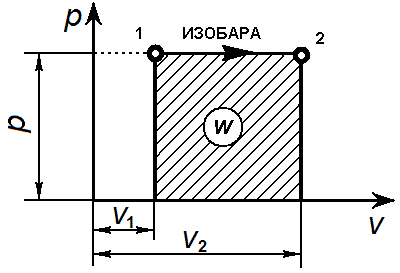
Уравнение изобарного процесса р= const.
Графически изобарный процесс в р—v-диаграмме изображается прямой линией, параллельной оси объемов. Линия изобарного процесса называется изобарой.
Связь между параметрами в изобарным процессе выража ется законом Гей-Люссака:
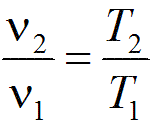
Изменение внутренней энергии газа рассчитывается по формуле:
![]()
В изобарном процессе происходит изменение объема рабочего тела, следовательно, совершается работа, определяемая:
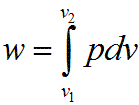
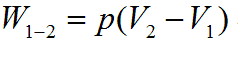
16. Изохорический процесс.
Изохорный процесс Уравнение изохорного процесса: v = const. Графически в p-v-диаграмме изохорный процесс изображается линией, параллельной оси давлений Линии изохорного процесса в диаграмме состояния называется изохорой
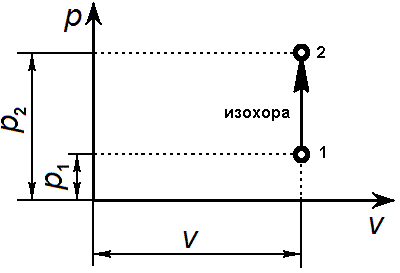
Связь между параметрами в изохорном процессе подчиняется закону Шарля
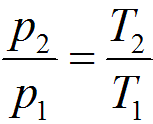 или
или
И изохорном процессе вся подведенная теплота расходуется на изменение внутренней энергии тела. Для тела с произвольной массой вещества m имеем:
![]()
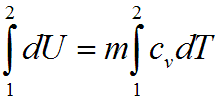
![]()
где cv — средняя массовая изохорная теплоемкость в интервале температур от T1, до Т2.
Так как в изохорном процессе нет изменения объема, то и работа по его изменению не совершается: W1-2 = 0.
Количество теплоты, подведенное в изохорном процессе, равно изменению внутренней энергии. Для произвольной массы вещества:
![]()
17. Адиабатический процесс.
Адиабатный процесс
Уравнение
адиабатного процесса имеет вид:![]()
где k =cp/cv -показатель адиабаты для идеального газа.
Графически адиабатный процесс на p-v-диаграмме изображается неравнобокой гиперболой, называемой адиабатой. Адиабата круче изотермы, так как к > 1.
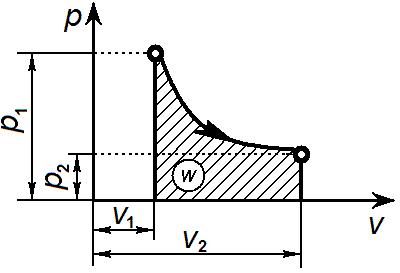
Связь между параметрами процесса определяется, используя уравнение адиабаты и уравнение состояния газа pv = RT:
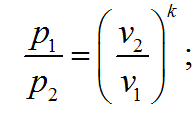
Работа в адиабатном процессе, совершенная 1 кг газа, может быть определена из уравнения первого закона термодинамики :
![]()
Так как в адиабатном процессе q=0, то:
![]()
и
![]()
то есть работа расширения в адиабатном процессе совершается за счет уменьшения внутренней энергии газа.
Адиабатный процесс протекает без подвода теплоты, следовательно Q=0.
18. Политропический процесс.
Так
называют процессы, уравнение которых
в переменных р,
V
имеет
вид
![]() (1)
где п
—
произвольное число
(1)
где п
—
произвольное число
![]() - показатель политропы, как положительное,
так и отрицательное, а также равное
нулю. Таким образом, любой процесс,
уравнение которого можно свести к виду
(1), является политропическим.
Соответствующую кривую называют
политропой.
Политропическими
являются, в частности, процессы
изохорический, изобарический,
изотермический и адиабатический.
Отличительной особенностью всех
политропических процессов является
то, что в ходе этих процессов теплоемкость
системы остается постоянной: С=const.
В зависимости от процесса можно определить
значение n: P=const,
n=0;T=const,
n=1;δQ=0,
n=γ,
γ=Cp/Cv;V=const,
n=∞
- показатель политропы, как положительное,
так и отрицательное, а также равное
нулю. Таким образом, любой процесс,
уравнение которого можно свести к виду
(1), является политропическим.
Соответствующую кривую называют
политропой.
Политропическими
являются, в частности, процессы
изохорический, изобарический,
изотермический и адиабатический.
Отличительной особенностью всех
политропических процессов является
то, что в ходе этих процессов теплоемкость
системы остается постоянной: С=const.
В зависимости от процесса можно определить
значение n: P=const,
n=0;T=const,
n=1;δQ=0,
n=γ,
γ=Cp/Cv;V=const,
n=∞
1
