

Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
Санкт-Петербургский государственный горный университет

Кафедра общей и физической химии
Отчёт по лабораторной работе № 2
По дисциплине: Химия
(наименование учебной дисциплины согласно учебному плану)
Тема: «Исследование комплексных соединений»
Выполнил: студент гр. РГГ-11 ______________ /Гуламов И.К/
(подпись) (Ф.И.О.)
Проверил: ассистент ____________ /Луцкий Д.С./
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2011
Цель работы: познакомиться с методами получения комплексных соединений и их свойствами.
Комплексными называют соединения, в структуре которых можно выделить центральный атом – акцептор электронов, находящийся в донорно-акцепторной связи с определённым числом доноров-лигандов. Лигандами могут быть как ионы, так и нейтральные молекулы. При диссоциации комплексные соединения диссоциируют на комплексный и внешнесферный ионы, например:
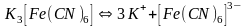
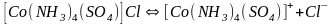
В первом случае соединение является анионным, так как содержит в своей структуре и образует при диссоциации в растворе комплексные анионы, а второй случай демонстрирует катионное соединение, поскольку при диссоциации – комплексный катион. Существуют и нейтральные соединения, у которых отсутствует внешняя сфера, а внутренняя не имеет никакого заряда, например: [Pt(NH3)2Cl2].
При записи формулы комплексного соединения его составные части располагают в порядке возрастания электроотрицательности. На первом месте помещают внешнесферные катионы, затем центральный атом, далее нейтральные лиганды, лиганды-анионы и в конце формулы записывают внешнесферные анионы. Читают формулу в английском языке слева направо, а в русском – справа налево, при этом название внутренней сферы произносят в одно слово, используя соединительную –о–, название комплексного аниона заканчивают суффиксом –ат. Степень окисления центрального атома при записи названия указывается римской цифрой в круглых скобках, заряды ионов – арабскими цифрами.
Число связей, образуемых лигандом с центральным атомом, называется дентатностью лиганда. Например, CN-, NH3 – монодентатные лиганды, а сульфат-анион - бидентатный лиганд. Число связей, образуемых центральным атомом с лигандами, называют координационным числом. Если лиганды монодентатные, то координационное число равно числу лигандов: в первом случае – 6, в третьем примере – 4. Однако во втором примере число лигандов равно 5, а координационное число кобальта – 6, поскольку сульфат-ион бдентатен.
Ход выполнения работ:
