
Электролиз растворов
Расплавы солей отличаются от расплавов солей тем что у них абсолютно нет воды т.к. соли плавятся гораздо выше 1000, катионы металлов высокой активности (щелочной метал и щелочноземельные металлы) не способны не способны восстанавливаться из водных растворов солей могут быть восстановлены из расплавов этих солей. Свободный фронт газообразный, анионы которого химическим путём окислить невозможно получают электролизом расплавов фторида металлов.
Пример: Рассмотрим электролиз расплавов соли К и F.
KF - K: K+ + e = K0
- K ← K+ + F - → A + + A: 2F - - 2e = F2
Если электролизу подвергается расплав содержащий катионы различных металлов, то последовательность их восстановления определяется величиной электродных потенциалов этих металлов. В первую очередь восстанавливаются катионы самого неактивного метала, а потом по возрастанию активности.
Практическое применение электролиза
Первое применение электролиза это использование для получения металлов. При получении металлов из раствора солей этот метод называется гидроэлектрометалургический способ получения металлов. Получение металлов из расплава солей называется пироэлектрометалургиеческой, этим способом получаются щелочные и щелочноземельные. Более широкое применение в технике имеет электролиз с растворимым анодом этот способ электролиза применяется при рафинировании металлов при гальваностегии и при гальванопластики.
Электрофинирование металлов — электролитическая очистка металлов. Рафинирование производится как расплавы металлов так и расплавы не металлов, чаще всего очищаются от меди и олова. Чаще всего подвергаются уже очищенные металлы.
Гальванопластика — это получение точных металлических копий с различных предметов обычно неметалл. В гальванопластике применяют обычно не металлический катод, но на поверхности катода наносят тонко проводимый слой, а затем слой антаангизива (вещество которое препятствует метала к катоду). В качестве анода будет метал из которого хотят получить металлическую копию.
№44.Сухой гальванический элемент Лекланше.
Начало формы
Л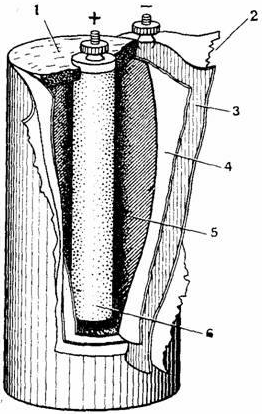 екланше
элемент,
гальванический элемент, в котором
положительный электрод изготавливается
из двуокиси марганца с добавкой графита
и сажи, отрицательный — из цинка. Л. э.
был предложен в 1865 французским химиком
Ж. Лекланше (G. Leclanche) и первоначально
состоял из цинкового стаканчика,
заполненного водным раствором хлористого
аммония или др. хлористых солей
(электролит), с помещенным в него
агломератом из двуокиси марганца с
угольным токоотводом. В более поздних
конструкциях «сухих» Л. э. электролит
стали загущать крахмалистыми веществами.
Начальное напряжение такого Л. э. —
1,4—1,6 в,
конечное —
0,7—0,9 в,
удельная энергия (w) 30—50 вт·ч/кг.
В 30 — 40-х гг. 20 в. были разработаны Л. э.
галетной конструкции с w 40—60 вт·ч/кг.
В 60-х гг. появились Л. э. со щелочным
электролитом — раствором едкого кали
(1,4—1,66; 0,9—1,0 б; w 60—90 вт·ч/кг),
которые стали постепенно вытеснять Л.
э. с солевым электролитом. Л. э. — наиболее
дешёвые и удобные химические источники
тока: они хорошо сохраняются,
транспортабельны, не требуют специального
ухода, всегда готовы к действию. Широко
применяются для питания переносной
радиоаппаратуры, карманных фонарей,
электрочасов, электроигрушек и т. п.
екланше
элемент,
гальванический элемент, в котором
положительный электрод изготавливается
из двуокиси марганца с добавкой графита
и сажи, отрицательный — из цинка. Л. э.
был предложен в 1865 французским химиком
Ж. Лекланше (G. Leclanche) и первоначально
состоял из цинкового стаканчика,
заполненного водным раствором хлористого
аммония или др. хлористых солей
(электролит), с помещенным в него
агломератом из двуокиси марганца с
угольным токоотводом. В более поздних
конструкциях «сухих» Л. э. электролит
стали загущать крахмалистыми веществами.
Начальное напряжение такого Л. э. —
1,4—1,6 в,
конечное —
0,7—0,9 в,
удельная энергия (w) 30—50 вт·ч/кг.
В 30 — 40-х гг. 20 в. были разработаны Л. э.
галетной конструкции с w 40—60 вт·ч/кг.
В 60-х гг. появились Л. э. со щелочным
электролитом — раствором едкого кали
(1,4—1,66; 0,9—1,0 б; w 60—90 вт·ч/кг),
которые стали постепенно вытеснять Л.
э. с солевым электролитом. Л. э. — наиболее
дешёвые и удобные химические источники
тока: они хорошо сохраняются,
транспортабельны, не требуют специального
ухода, всегда готовы к действию. Широко
применяются для питания переносной
радиоаппаратуры, карманных фонарей,
электрочасов, электроигрушек и т. п.
Элемент Лекланше.
1 – воск,
2 – бумажная оболочка,
3 – цинковый цилиндр,
4 – пористая перегородка,
5 – электролит,
6 – угольный стержень, окруженный окисью марганца.
