[Править] Внутренняя энергия идеального газа
Тепловое движение
молекул одноатомного газа идёт тем
интенсивнее, чем больше его внутренняя
энергия
Основная
статья: Внутренняя
энергия
Согласно
закону
Джоуля, выведенному экспериментально,
внутренняя энергия идеального
газа не зависит от давления или
объёма газа. Исходя из этого факта, можно
получить выражение для изменения
внутренней
энергии идеального газа. По
определению молярной
теплоёмкости при постоянном
объёме,
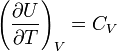 [13].
Так как внутренняя энергия идеального
газа является функцией только температуры,
то
[13].
Так как внутренняя энергия идеального
газа является функцией только температуры,
то
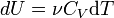
|
(2)
|
|
где:
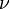 —
число молей идеального газа.
—
число молей идеального газа.
[Править] Уравнение Пуассона
Для
идеальных
газов в случае квазистического
процесса адиабата имеет
простейший вид и определяется
уравнением[5][11]:
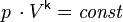
где:

График адиабаты
(жирная линия) на
 диаграмме
для газа.
p — давление газа;
V —
объём.
диаграмме
для газа.
p — давление газа;
V —
объём.
С
учётом уравнения
состояния идеального газа
уравнение адиабаты может быть преобразовано
к виду:
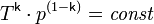 ,
,
где
T — абсолютная
температура газа. Или к виду:
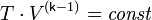
Поскольку
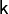 всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении V) газ нагревается
(T возрастает), а при расширении —
охлаждается, что всегда верно и для
реальных газов.
всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении V) газ нагревается
(T возрастает), а при расширении —
охлаждается, что всегда верно и для
реальных газов.
[Править] Вывод уравнения
Согласно
закону
Менделеева — Клапейрона[5]:
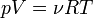
Продифференцировав
обе части, получаем:
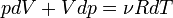
|
(3)
|
|
Если
в (3)
подставить dT из (2),
а затем dU из (1),
получим:
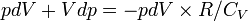 ,
,
или,
введя коэффициент
:
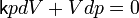 .
.
Или
 ,
,
что
после интегрирования даёт:
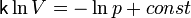 .
.
Окончательно
имеем,
,
что
и требовалось доказать.



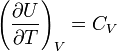 [13].
Так как внутренняя энергия идеального
газа является функцией только температуры,
то
[13].
Так как внутренняя энергия идеального
газа является функцией только температуры,
то