
Особливості прояву l-s зв’язку(правило інтервалів).
Ми вже говорили, що мультиплетність станів обумовлена спін-орбітальною взаємодією. Можна записати формулу для мультиплетного розщеплення у випадку L-S зв’язку.
ΔEj,j+1= A(J+1).
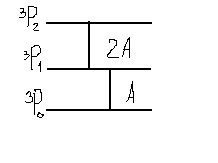
Це співвідношення відоме як правило інтервалів Ланде. Згідно якого віддаль між сусідніми рівнями мультиплета пропорційна більшому квантовому числу J. Проілюструємо це для 3P0,1,2 –мультиплетність.
 Згідно
ΔEj,j+1=
A(J+1):
ΔE0,1=A
; ΔE1,2=2A.
Згідно
ΔEj,j+1=
A(J+1):
ΔE0,1=A
; ΔE1,2=2A.
Виконання цього співвідношення свідчить про реалізацію нормального зв’язку(Згадати лабораторну роботу). Зв’язок РС справедливий для відносно легких атомів з Z ≤ 30 коли взаємодія спінового моменту із орбітальним – менша взаємодії орбітальних і спінових моментів електронів між собою.
J-J - зв’язок .
При збільшенні атомного номеру Z > 30 зв’язок РС порушується, і необхідно віддавати перевагу взаємодії між спіном та орбітальним моментом кожного електрона.
Спочатку визначають повний момент для певного електрона(і-того):
=і
+
і
,повний
момент
знаходимо
як векторну суму компонент:
= і
, вектору
ставиться у відношення квантове число
J
(це як було для RS
– зв’язку
=L
,
=S
,
=J).
і
, вектору
ставиться у відношення квантове число
J
(це як було для RS
– зв’язку
=L
,
=S
,
=J).
Запишемо можливі стани для sp- конфігурації:
s1=1/2, 1=0, J1=1/2 J=J1+J2, … J1-J2 , J1 -……., J2 – два значення.
s2=1/2, 1=1, J2=3/2;
J(1/2,3/2) = 2,1
J(1/2,1/2)= 1,0 .
Стани записують : (1/2,3/2)2 (1/2,3/2)1
(1/2,1/2)1 (1/2,1/2)0
Знайдемо можливі стани для sp – конфігурацій, але для зв’язку Рассел-Саундерса:
sp 1=0, 2=1, L=0 P
s=0, s=1, χ=1, χ=3 1P1 3P0,1,2
Порівняєм енергетичні схеми:
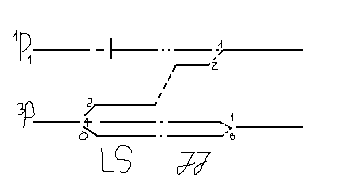
(3/2,1/2)
(1/2,1/2)
Як бачимо кількість рівнів для конфігурацій sp для обох типів зв’язку однакова. Оскільки позначення РС більш простіший для J-J зв’язку, на практиці використовують систематику РС і для атомів із Z > 30.
Правила відбору для спектральних переходів.
Правило відбору отримують при квантово-механічному аналізі хвильових функцій відповідних станів. Тут показується, що випромінювальні переходи дозволені, якщо виконуються наступні умови для квантових чисел в рамках LS – зв’язку:
ΔL=±1
ΔS= 0,±1
ΔJ=0,±1 , за винятком, коли J1=J2=0.
Енергетичні рівні та переходи для атома гелію.
Розглянемо для прикладу спектри атома гелію та ртуті. Атом гелію має 1s2-конфігурацій і на його прикладі можна розглянути закономірності спектрів в легких атомах, атоми ртуті – приклад порушення зв’язку Рассел-Саундерса і відповідно правил відбору для оптичних переходів(Z = 80).
А) Атом гелію.
Основний стан – 1s2-конфігурацій. Йому відповідає терм, що утворюється двома е- із однаковими n та , а тому, згідно принципу Паулі електрони повинні відрізнятися спінами.
Отже, 1=0, 2=0, s1=1/2, s2=1/2, тоді L=0 => S - ….. ….. …. S=0, χ =1, S0 – терм основного стану. Збуджені стани відповідають випадку, коли один з електронів залишається в 1s – стані, а інший займає положення n- станів, отже збуджені стани будуть мати конфігурації: 1s2s, 1s2p, 1s3s, 1s3p, 1s4s, 1s3d. Кожна з цих конфігурацій буде мати систему триплетів і синглетів, оскільки електрони на орбітах – нееквівалентні і можуть орієнтуватись двояко – паралельно і антипаралельно, формуючи стани з χ=1, χ=3.
1s2s- 3S1 3S0 ; 1s2p – 3P0,1,2 1P1 ; 1s3s – 3S1 1S0 ; 1s3p – 3P0,1,2 1P1 ; 1s3d – 1D2 1D1,2,3
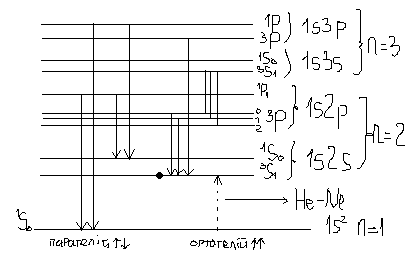
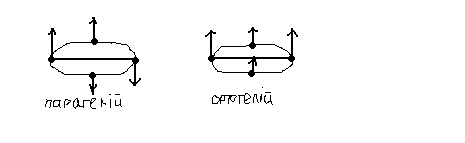
Для гелію дозволеними є переходи із ΔS=0, отже переходи можуть відбуватись тільки між синглетами або тільки між триплетами. Відповідні переходи формують серії, що може здатись, що існує дві модифікації гелію. Їх так умовно(бо вони не існують) і називають парагелієм і ортогелієм. В дійсності за парагелієм стоять переходи між атомами із протилежними спінами, а за ортогелієм – паралельні спіни.
{ще зупинимось на 3s1 – рівні. Цей рівень не залишається внаслідок оптичних переходів, і з цього рівня заборонені випромінювальні переходи. Така ситуація призводить до великого часу життя в таких станах. Якщо, звичайно, час життя для випромінювальних переходів ~ 10-8 с, то тут це складає 10-3с. Такі рівні називають метастабільними. Вони відіграють важливу роль у створенні лазерів. Дезактивація цих станів може відбуватись за рахунок співударів з іншими атомами}.
Б) Енергетичні рівні і спектр атома ртуті.
Прикладом елемента з двома електронами на зовнішній оболонці є атом ртуті – 6s2. Ртуть широко використовується як газовий наповнювач для різного роду газорозрядних джерел світла, наприклад, ртутні лампи – де електронний розряд в парах ртуті збуджує атоми ртуті, які при поверненні в основний стан випромінюють. Люмінісцентні лампи – мають ртутне газове наповнення. Тут енергія випромінювання ртуті збуджує люмінофор нанесений на стінку скляної колби. Люмінофор в свою чергу випромінює видимим світлом. Для Hg можливі наступні енергетичні рівні:
основні стани:
6s2,1=0, 2=0, L=0, L=S, s1=1/2, s2=1/2 ,згідно принципу Паулі вони повинні бути антипаралельні. Отже mp=1/2, ms=-1/2. Тобто S=0, χ=1
J=L+S=0, основні стани 1S0
збуджені стани:
6s6p , 1=0, 2=1, L=1, P
S = s1+s2 S = s1-s2
S=1 S=0
χ=3 χ=1
J=L+S…L-S J=L+S…L-S
J=2,1,0 J=1
3P0, 3P1, 3P0 1P1
6s7s: L=S<0 L=S=0 6s6d: L=2=D
S=1 S=0 S=1 S=0
χ=3 χ=1 χ=3 χ=1
J=1 J=0 J=3,2,1 J=2
3S1 1S0 3D1, 3D2, 3D1 1D0
Намалюємо схему енергетичних рівнів:
1P0 – 1S0 – 185 нм
3P1 – 1S0 – 254 нм
3S1 3P2 – зелена – 546 нм
3P1 – синя – 436 нм
3P0 – фіолетова – 405 нм
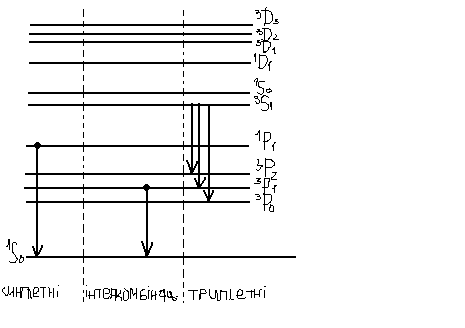
Для атомів важких елементів правило Р.-С. виконується тільки формально. Правила відбору по спіну ΔS=0 користуються і дозволеними ….переходи у ΔS=±1, так звані інтеркомбінаційні переходи.
