
- •Могут ли в атоме находиться три электрона с одинаковой энергией?
- •Какая система называется изолированной?
- •Какое состояние называется основным?
- •Какие электроны называются валентными?
- •Что определяет валентность атома?
- •Скольким атомам принадлежит электрон, участвующий в образовании металлической связи?
- •В результате чего образуется электронная энергетическая зона в металле?
- •Чему равен индекс узла, в котором находится центральный атом элементарной ячейки оцк-решетки, если начало координат расположено в вершине куба?
- •Какое равновесие должно наступить первым: фазовое или химическое?
- •К каким растворам относится термин «сверхструктура»?
- •Что такое фаза внедрения?
- •Что такое электронное соединение?
- •Что означает равенство значений энергии Гиббса для разных фаз при некоторых значениях температуры и давления?
- •Покажите на р-т- диаграмме состояния однокомпонентной системы кривые: сублимации, плавления, кипения.
- •Какого рода фазовое превращение происходит в системе, если при этом δн ≠ 0 и δСр ≠ 0?
- •В каких случаях объемный эффект фазового превращения меньше нуля?
- •В каком случае из аустенита получается пластинчатый перлит, а в каком – зернистый?
- •При каких переохлаждениях получается бейнитная структура?
- •Переползание происходит параллельно или перпендикулярно плоскости скольжения?
- •Поясните скольжение винтовой дислокации.
Вопросы без ответов:
39, 51, 69, 71, 90, 93, 95, 96, 100-136, 147, 151, 153, 154, 156, 157, 161, 162, 165-170, 175-177, 179, 182-185, 187, 188, 192, 236, 245, 251-253, 269, 283, 284, 288, 290, 293, 295, 296, 298, 301-420, 422, 431, 434, 436, 437, 439, 442, 443, 469-470, 472, 476, 501-619.
Могут ли в атоме находиться три электрона с одинаковой энергией?
Никакие два электрона в одном атоме не могут характеризоваться одинаковым набором всех четырех квантовых чисел n, l, m, s (принцип Паули). Следовательно, количество электронов имеющих одинаковую энергию может быть не больше двух (при разном s).
Какая система называется изолированной?
ИЗОЛИ́РОВАННАЯ СИСТЕ́МА (замкнутая система) - термодинамическая система, помещенная в оболочку, исключающую обмен теплом и веществом с внешней средой, то есть адиабатически изолированная от внешней среды. Состояние такой системы может быть изменено только в результате изменения внешних параметров (например, объема). В изолированной системе всегда устанавливается термодинамически равновесное состояние.
Какое состояние называется основным?
Основное состояние атома - энергетически стабильное состояние, когда атом не подвергается сильным внешним воздействиям.
Какие электроны называются валентными?
Валентными электронами называют электроны, находящиеся на внешней, или валентной, оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановителя) в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он приобретает электроны (проявляет свойства окислителя) в химических реакциях при прочих равных условиях. Полностью заполненные внешние электронные оболочки имеют инертные газы, которые проявляют минимальную химическую активность. Периодичность заполнения электронами внешней электронной оболочки определяет периодическое изменение химических свойств элементов в таблице Менделеева.
Что определяет валентность атома?
Валентность определяется, как число химических связей, которыми данный атом соединен с другими. Число же связей, которые может образовывать атом, равно числу его неспаренных электронов. И валентность атома элемента в простейших случаях определяется числом неспаренных электронов в нем, идущих на образование общих электронных пар. При этом не учитывается полярность образовавшихся связей, а потому валентность не имеет знака. Валентность, определяемая, как число связей, не может быть ни отрицательной, ни нулевой.
Скольким атомам принадлежит электрон, участвующий в образовании металлической связи?
Всем атомам металла.
В результате чего образуется электронная энергетическая зона в металле?
Согласно постулатам Бора, в изолированном атоме энергия электрона может принимать строго дискретные значения (также говорят, что электрон находится на одной из орбиталей).
В случае нескольких атомов, объединенных химической связью (например, в молекуле), электронные орбитали расщепляются в количестве, пропорциональном числу атомов, образуя так называемые молекулярные орбитали. При дальнейшем увеличении системы до макроскопического кристалла (число атомов более 1020), количество орбиталей становится очень большим, а разница энергий электронов, находящихся на соседних орбиталях, соответственно очень маленькой, энергетические уровни расщепляются до практически непрерывных дискретных наборов — энергетических зон.
Сколько электронов обобществляется при ванн-дер-ваальсовом взаимодействии?
Ван-дер-Ваальсово взаимодействие двух молекул на сравнительно больших расстояниях имеет характер возмущения электронного облака одной молекулы электронным облаком другой.
Из каких частиц состоит остов кристаллической решетки металла?
Атомов, ионов и молекул..
Сколько кристаллитов содержит монокристалл?
Множество.
Чем отличается точечная и пространственные группы симметрии?
В отличие от точечной группы симметрии, которая описывает внешнюю форму и симметрию физических свойств кристалла, пространственная группа симметрии характеризует симметрию его структуры.
Сколько плоскостей симметрии у куба?
Куб имеет девять плоскостей симметрии: шесть диагональных плоскостей и три плоскости, проходящие через середины каждой четвёрки его параллельных рёбер.
Поворотные оси какого порядка и сколько таких осей у куба?
Куб имеет три поворотные оси 4-го порядка, 6 поворотных осей 2-го порядка, проходящих через середины противоположных параллельных рёбер, а так же четыре поворотные оси 3-го порядка, совпадающие с внутренними диагоналями куба. Таким образом, куб имеет всего 13 поворотных осей, среди которых встречаются оси 2-го, 3-го и 4-го порядка.
Сколько центров симметрии у куба?
Центром симметрии является точка пересечения диагоналей куба. Один.
Сколько у куба инверсионных осей симметрии и какого они порядка?
У куба есть три оси 4-го порядка, которые проходят через центры противоположных граней, 4 оси 3-го порядка, являющиеся пространственными диагоналями куба и 6 осей 2-го порядка, проходящих через середины пар противоположных ребер. Все оси симметрии куба пересекаются в одной точке в центре куба.
Сколько периодов кубической решетки содержит единичная трансляция в направлении [100]?
1 период.
Покажите плоскость скользящего отражения в ГЦК-решетке?
Деформация скольжением развивается по плоскостям и направлениям, на которых плотность атомов максимальна (рис. 4.3). Плоскость скольжения вместе с направлением скольжения, принадлежащим этой плоскости, образует систему скольжения. Число систем скольжения неодинаково в металлах с разным типом решеток. У металлов с ГЦК решеткой (Си, А1, Ni и др.) скольжение идет по плоскостям {П1} в направлениях < ПО>. Четыре плоскости скольжения и три направления скольжения в каждой из них образуют 12 эквивалентных систем скольжения.
В металлах с ОЦК решеткой скольжение развивается по плоскостям {ПО}, {112} и {123} в направлениях <111>, число систем скольжения - 48.
У металлов с ГПУ решеткой при с/а > 1,63 (Mg, Zn) скольжение развивается по плоскости базиса, в которой находятся три эквивалентных направления. Эти металлы менее пластичны, чем металлы с ОЦК и ГЦК решетками. Число систем скольжения может увеличиться, если уменьшаются критические напряжения сдвига в других
[7 ] \
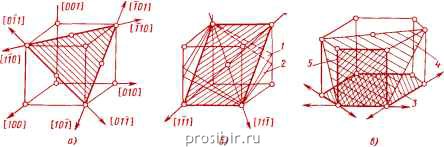
Покажите винтовую ось второго порядка в ОЦК-решетке?
Ответ: винтовая дислокация, которая представляет собой некоторую условную ось внутри кристалла, вокруг которой закручены атомные плоскости (рис.1.11).

