
Задание к самостоятельной работе №2 «Химическая термодинамика. Химическое равновесие. Кинетика химических реакций.»
Задача 1.
В вариантах (18-30) по заданным термохимическим уравнениям (табл. 3) рассчитайте стандартную энтальпию реакции образования указанного вещества f H 0298 из простых веществ.
Таблица 3
№ п/п |
Термохимические уравнения реакций r H o , кДж |
Вещество |
25 |
(I) Ce(т) + O2(г) = CeO(т); r H oI = - 1090 (II) 3CeO2(т) + Ce(т) = 2Ce2O3(т); r H oII = - 332 |
Ce2O3 |
Изменение энтальпии химической реакции зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий, следовательно изменение энтальпии реакции :
2Сe(т)+3/2O2(г)=Ce2O3 (т) r H o298
будет равно: утроенное третей реакции плюс вторую реакцию, и все это деленное на два, тогда:
r Н o298=(3 r НoI + r Н oII)/2 = (-1090*3+(-332)) /2=-1801 кДж/ моль
Задача 2.
Используя данные табл. 8, и справочные данные
в вариантах (25-30) рассчитайте стандартную энтропию (∆ S0) исходного вещества [Дж/(моль•К)], если известна стандартная энтропия реакции ( rS 0298).
Таблица 8
№ п/п |
Уравнения реакций |
r So , Дж/K |
25 |
5KClO4(к) = 4KClO3(к) + KCl(к) + 4О2( г) |
+871 |
5KClO4(к) = 4KClO3(к) + KCl(к) + 4О2( г)
! я сменила коэффициенты в вашем уравнении реакции, т.к они были даны не правильно !
Энтропия реакции равен сумме энтропий образования продуктов реакции за вычетом суммы энтропий образования исходных веществ, следовательно:
r S0298=4S0298(KClO3(k))+ S0298(KCl(k))+4S 0298(O2(г)))-5S0298(KClO4 (k))=871 Дж /K
Отсюда:
S 0298 (KClO4 (k))=( 4S0298(KClO3(k))+ S0298(KCl(k))+4S 0298(O2(г)))- r S0298)/5
По справочным таблица определяем энтальпии образования веществ:
S 0298(KClO3(k))= 142,95 Дж/(моль*К)
S 0298(KCl(k))= 82,55 Дж/(моль*К)
S 0298(O2(г))= 205,04 Дж/(моль*К)
S 0298 ((Al2(SO4)3 (т))= (4*142,95+82,55+4*205,04-871)/5= 120,7 Дж/(моль*К)
Задача 3
для заданной химической реакции (табл. 9) выпишите из справочника необходимую информацию для расчетов rH0298, rS0298, rG0298, а также температурные области существования исходных веществ и продуктов реакции.
Считая, что стандартные энтальпия и энтропия реакции не зависят от температуры (DrС0р = 0)
определите:
rG0298 реакции (двумя способами),
область температур, в которой возможно самопроизвольное протекание реакции в прямом направлении при стандартных состояниях и постройте график зависимости rG0 = f(T) для заданного процесса;
rG0Т,
константу равновесия Kр (R = 8,31 Дж/моль*К) и KC (R = 0,082 л*атм/моль*К), при заданной температуре T (табл.9)
укажите, в каком направлении протекает реакция при заданной температуре T и направление смещения равновесия при увеличении T. При обосновании направления смещения равновесия используйте уравнение изобары Вант-Гоффа.
используя уравнение изотермы Вант-Гоффа, рассчитайте rGТ при температуре T (для начального момента реакции), если исходные парциальные давления газов (P, табл. 9) в реакционной смеси соответственно равны PA, PB, PC, PD. Сравните полученный результат со стандартным значением энергии Гиббса rG0Т.
Таблица 9
№ п/п |
Уравнение реакции |
Т, К |
P*10-4 Па |
|||
А |
B |
C |
D |
|||
25 |
2CrCl3(k) 2CrCl2(k) + Cl2(г) |
500 |
- |
- |
- |
0,5 |
! В предложенных справочниках я не нашла данных для CrCl2, поэтому взяла их с сайта www.xumuk.ru, но там нет данных по температурным областям существования!
2CrCl3(k) 2CrCl2(k) + Cl2(г)
По справочным таблица определяем энтальпии образования Указанных в условии веществ:
f H 0298 (CrCl3(k))=-556,47кДж/моль
f H 0298(CrCl2 (k))= -395,34 кДж/моль
f H 0298(Сl2(г))= 0кДж/моль
S 0298 (CrCl3(k))=123,01 Дж/(моль*K)
S 0298(CrCl2 (k))= 115,65 Дж/(моль*K)
S 0298(Сl2 (г))= 222.98 Дж/(моль*K)
f G 0298 (CrCl3(k)=- 486,37кДж/моль
f G 0298(CrCl2 (k))= -356,34кДж/моль
f G 0298(Сl2 (г))= 0кДж/моль
Температурные области существования:
CrCl3 - 298-1218
CrCl2- -
Сl2- 298-3000К
Рассчитаем энтальпию и энтропию данного процесса:
r H 0298= f H 0298 (Сl2 (г))+2 f H 0298(CrCl2 (k))- 2 f H 0298(CrCl3 (k))= 322.26 кДж
r S 0298= S 0298 (Сl2 (г))+ 2S 0298(CrCl2 (k))- 2S 0298(CrCl3 (k))= 208.26 Дж/к= 0,20826кДж/К
Изменение энергии Гиббса определяется по уравнению:
r G 0298= r H 0298-T r S 0298=322.26-298*0,20826=260.19 кДж
Изменение энергии Гиббса возможно и другим способом:
r G0298= fG0298 (Сl2 (г))+2 f G 0298(CrCl2 (k))- 2 f G 0298(CrCl3 (k))=260.06 кДж
При данной температуре изменение энергии Гиббса больше нуля , следовательно реакция не будет самопроизвольно протекать в прямом направлении.
Определим температуру , когда данная система находится в состоянии химического равновесия.
Для состояния химического равновесия ( когда протекает и прямая и обратная реакции) характерно изменение энергии Гиббса равное нулю:
r G 0298= r H 0298-T r S 0298=0
r G 0298=322.26-Т*0.20826=0
Т=322.26/0.20826=1547 К
Т.о данная возможна при температурах выше 1547 К
Рассчитаем изменение энергии Гиббса при температуре 500 К( взята из таблицы) . Т.к по условию задания энтальпия и энтропия не зависят от температуры, то для расчета изменения Энергии Гиббса при 500К воспользуемся уравнением:
r G 0400= r H 0298-T r S 0298=322.26-500*0.20826=218.13 кДж
Построим график зависимости rG0 = f(T) для данного процесса :
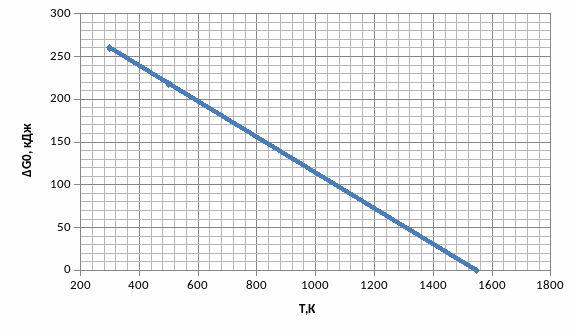
Т.о данная реакция возможна при температурах выше 1547 К
Рассчитаем константу равновесия реакции, для этого воспользуемся уравнением:
r G 0500=-2,3RTlgКр
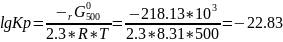
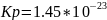
Рассчитаем Кс:

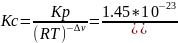
Т.к при заданной температуре (500К) изменение энергии Гиббса больше нуля, то реакция самопроизвольно будет протекать в обратном направлении.
Согласно
уравнению изобары Вант-Гоффа константа
равновесия и температура связаны между
собой:
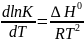
Рассмотрим
как влияет изменение температуры на
константу равновесия. В правую часть
уравнения входит тепловой эффект
химической реакции, следовательно
зависимость константы равновесия от
температуры определяется знаком и
величиной теплового эффекта. В нашем
случае реакция является эндотермической
r
H
0298>0
, тогда согласно уравнения изотермы
Вант-Гоффа
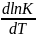 >0
и К увеличатся при увеличении
температуры.
>0
и К увеличатся при увеличении
температуры.
Запишем выражение изотермы Вант-Гоффа
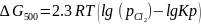
Произведем расчеты:
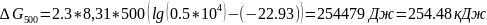
Т.о полученный результат отличается от стандартных значений, т.к вещества взяты в других соотношениях.
Задача 4
В вариантах (15 - 23) для данной гомогенной реакции А + В Û С +D ( табл.11) определите температуру, при которой наступает равновесие. Температурной зависимостью D r H 0 и D r S 0 можно пренебречь. Рассчитайте равновесный состав системы при этой температуре, если известны начальные концентрации исходных веществ C0 (продукты реакции в начальный момент времени отсутствуют).
Таблица 11
№ п/п |
Уравнение реакции |
С 0, моль/л |
|
А |
В |
||
25 |
CO (г) + NO (г) = CO2 (г) + ½ N 2 (г) |
0,5 |
0,5 |
По справочным таблица определяем энтальпии образования Указанных в условии веществ:
f H 0298 (N 2 (г))=0 кДж/моль
f H 0298(CO 2 (г))= -393.51 кДж/моль
f H 0298(CO (г))=-110.53 кДж/моль
f H 0298(NO (г))= 91.26 кДж/моль
S 0298 (NO (г))= 210.67 Дж/(моль*K)
S 0298(CO 2 (г))= 213.66 Дж/(моль*K)
S 0298(CO (г))= 197.55Дж/(моль*K)
S 0298(N2 (г))= 191.50 Дж/(K*моль)
Рассчитаем энтальпию и энтропию данного процесса:
r H 0298= f H 0298 (CO2 (г))+1/2 f H 0298(N 2 (г))- f H 0298(NO (г))- f H 0298(CО (г)))= (-393.51)+1/2*0-91.26-( -110.53)=-374.26 кДж
r S 0298= S 0298 (CO2 (г))+1/2 S 0298(N 2 (г))- S 0298(NO (г))- S 0298(CО (г)))=322.5 Дж/к=0.3225кДж/К
Для состояния химического равновесия ( когда протекает и прямая и обратная реакции) характерно изменение энергии Гиббса равное нулю:
r G 0298= r H 0298-T r S 0298=0
r G 0298=-374.263-Т*0.3225=0
Т=-1160 К
Т.о. данная реакция возможна при любой температуре. Т.к. данная реакция возможна при любой температуре рассчитаем равновесный состав при 500К.
r G 0500=-374.263-500*0.3225=-535,49
Рассчитаем константу равновесия при данной , для этого воспользуемся уравнением:
r G 0=-2,3RTlgКр
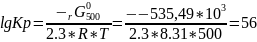
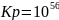
Рассчитаем Кс:
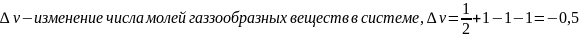
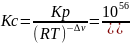
Запишем выражение константы равновесия для данной реакции:
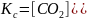
CO (г) + NO (г) = CO2 (г) + ½ N 2 (г)
Обозначим через х моль/л концентрацию СО вступившего в реакцию. Согласно уравнения реакции для получения 1 моль СО2 и 1/2 мольN2, необходимо израсходовать 1 моль СО и 1 моль NO, следовательно при реакции х моль/л СО выделится 0,5х моль/л N2 и 1 моль СО2, и израсходуется х моль NO, тогда:

Х≈0,5 моль/л

