
- •1 Закон : Весовые количества выделяющихся при электролизе веществ пропорциональны количеству прошедшего через раствор электричества и не зависят от каких-либо других факторов.
- •1. Соль образована слабой кислотой и сильным основанием, например, ацетат натрия сн3 cooNa ,образованный слабой уксусной кислотой сн3 cooNa и сильным основанием NaOh.
- •4.Соли, образованные сильным основанием и сильной кисло
- •2. Гидролиз сульфита натрия
Министерство общего и профессионального образования Российской Федерации
Камский политехнический институт
РУКОВОДСТВО К ЛАБОРАТОРНО-ПРАКТИЧЕСКИМ ЗАНЯТИЯМ В КУРСЕ ХИМИИ
Часть YI. Электрохимия и гидролиз солей
Набережные Челны 1997
УДК 541:13:620.198
Руководство лабораторно-практическим занятиям в курсе химии. Часть YI./ Составители: Макогон С. И., Маврин Г.В., Мифтахое М.Н., Соколов М.П., Исмаилов Э.Ш. - Набережные Челны: КамПИ, 1997, 60 с.
Методические указания предназначены для студентов дневной и заочной форм обучения. Описаны теоретические основы и порядок выполнения лабораторных работ по темам: гальванические элементы и ряд напряжений металлов, электролиз и гальванические покрытия, коррозия и защита металлов от коррозии, гидролиз солей.
Рецензент: кандидат химических наук Газизов И.Г.
Печатается по решению научно-методического совета Камского политехнического института от 16 декабря 1996 года.
Камский политехнический институт, 1997г.
ЛАБОРАТОРНАЯ РАБОТА
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ И РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
ЦЕЛЬ РАБОТЫ: познакомить студентов с общими теоретическими вопросами об устройстве и работе гальванических элементов, принципом расчета равновесных потенциалов металлов и ЭДС гальванических элементов, закрепить их знания путем проведения самостоятельной экспериментальной работы по определению ЭДС нескольких гальванических элементов.
ПРОГРАММА К КОЛЛОКВИУМУ
1. Какие приборы называются гальваническими элементами? 2.Что представляет собой водородный электрод?
3.Что называется стандартным электродным потенциалом?
4.Как по формуле Нернста определить значение равновесного потенциала?
5.Что называется равновесным электродным потенциалом?
6.Как расчитать ЭДС гальванического элемента, используя формулу Нернста?
7.Составить два гальванических элемента, в одном из которых медь бы являлась катодом, а в другом - анодом.
8.Определить ЭДС гальванического элемента, построенного из следующих полуэлементов: а) цинка, погруженного в 0,001 М - раствора Zn SO4, б) меди, погруженной в 1 М раствора Cu SO4 .
9.Рассчитать ЭДС элемента, образованого никелевым электродом, погружённым в раствор 0,1 М концентрации и медным электродом, погруженным в l М раствора Cu SO4, считая диссоциацию солей полной.
10. Выразить молекулярными и ионными уравнениями происходящие при работе элемента реакции.
Теоретические основы метода выполнения работы
При окислительно-восстановительных реакциях электроны, теряемые восстановителем, непосредственно переходят к
окислителю. Например, при погружении цинковой пластины в раствор серной кислоты, электроны, теряемые атомами цинка, непосредственно на металле поглощаются ионами водорода.
Эта реакция сопровождается выделением тепла. Здесь имеет место химический процесс, не связанный с образованием электрического тока.
окисление
Zn + Н2 SO4 = Zn SO4 + Н2
восстановление
восстановитель |- е | Zn - 2 е = Zn++
окислитель |+ е | 2Н + 2 е = Н 2
Окислительно-восстановительную реакцию можно провести в таких условиях, при которых процессы окисления и восстановления будут протекать раздельно. Этого можно достигнуть , если в тот же раствор серной кислоты одновременно с цинковой погрузить медную пластинку, соединив их предварительно между собой металлическим проводником (рис.1).При этом цинк также растворяется, но выделение водорода происходит уже на медной пластинке. Следовательно, в этом случае электроны, теряемые атомами цинка, прежде, чем соединиться с ионами водорода (реакция 1).должны пройти некоторый путь по медному проводнику. Известно, что такое направленное движение электронов представляет собой электрический ток, наличие которого может быть подтверждено включенным в цепь гальванометром или другим электроизмерительным прибором. Таким образом, здесь уже имеет место электрохимический процесс приращения химической энергии в электрическую энергию. Устройство , в котором химическая энергия реакции окисления-восстановления превращается в энергию электрического тока, называет гальваническим элементом или химическим источником тока (ХИТ). Рассмотренный гальванический элемент носит название! Вольта.
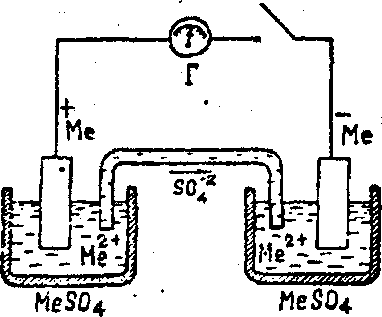
Возникновение электрического тока можно наблюдать, если цинковую и медную пластины , соединенные проволокой, погрузить в растворы соответствующих солей, разделенные диафрагмой (рис.2). В основе работы гальванического элемента (он называется элементом Якоби-Даниэля) лежит следующая окислительно-восстановительная реакция:
восстановление
Cu SO4 + Zn = Zn SO4 + Cu
окисление
восстановитель |- e| Zn - 2 e → Zn++
окислитель |+ e| Cu++ + 2 е → Cu
Реакция в растворе легко обнаруживается по вытеснению металлическим цинком ионов меди из раствора сульфата меди. В этом случае электроны от атома цинка непосредственно переходят к ионам меди, образование электрического тока не наблюдается. Проводя эту реакцию в гальваническом элементе (рис.2),мы разделяем процессы окисления и восстановления и добиваемся возникновения электрического тока.
(Следовательно , в основе работы любого гальванического элемента лежит окислительно-восстановительная реакция, протекающая так, что на одном из электродов происходит окисление, а на другом - восстановление. Тот электрод, который в процессе работы гальванического элемента окисляется и посылает электроны во внешнюю цепь, называется анодом ( в элементе Якоби-Даниэля - цинк) . Электрод, на котором имеет место процесс восстановления, называется катодом ( в элементе Якоби-Даниэля - медь).Значит анод в гальванических элементах имеет знак минус, а катод - плюс. Название электрода определяется не его знаком, а протекающим на нем процессом. В гальванических элементах и при электролизе электрод, который окисляется - анод, на котором происходит восстановление - катод. Для условного изображения гальванических элементов принята специальная форма записи, при которой все составляющие их вещества записываются подряд в одну строку. При этом отрицательный электрод записывается слева , а положительный - справа. Одна вертикальная черточка на схеме означает границу между металлом и раствором, а две линии - границу между растворами. Например, медно-цинковый гальванический элемент изображается так:
‾Zn | Zn SO4 | | Cu SO4 | Cu+
Причину возникновения электродвижущей силы (сокращенно ЭДС) в гальванических элементах можно объяснить так. Представим , что пластинка цинка опущена не в раствор Н2SO4 или Zn SO4 а в воду. Тогда поверхностные ионы металла под действием сильно полярных молекул воды гидратируются и связь их с остальными ионами е кристаллической решетке ослабляется. Это приводит к отрыву части ионов от металла и переходу их в слой воды, непосредственно прилегающий к пластине. Слой воды вблизи пластины заряжается положительно, а в металле остается избыточное количество электронов, придающих ему отрицательный заряд. Образуется двойной электрический слой , возникает разность потенциалов между металлом и прилегающим к нему слоем воды (точнее, между металлом и раствором, т. к. вода уже содержит некоторое количество , ионов металла (рис.3).
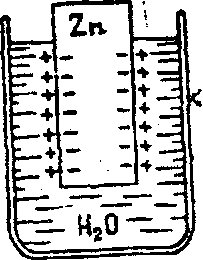
Рис. 3.
Схема возникновения заряда на цинковой пластине .
Подобное взаимодействие происходит при погружении любого металла не только в чистую воду, но и в раствор его соли. Очевидно, в последнем случае различие заключается лишь в большей концентрации ионов данного металла в растворе.
Схематически процесс образования двойного электрического слоя мерно представить так:
+n +n электроны,
Me * ne + m H2O = Me * m H2O + ne оставшиеся
в металле
Электронейт- Гидратирован-
ральный атом ный катион
металла
электрическое притяжение между гидратированными ионами в растворе и противоположно заряженной пластинкой металла препятствует дальнейшему течению процесса, и в системе устанавливается динамическое равновесие.
Любой металл, погруженный в воду или в раствор электролита, принято называть электродом , а разность электростатических потенциалов, возникающую на границе между металлом и раствором - электродным потенциалом.
Электродный потенциал, соответствующий состоянию равновесия, при котором скорость перехода ионов в раствор равняется скорости обратного их осаждения, называется равновесным потенциалом. Это равновесие у различных металлов отвечает разной концентрации ионов в растворе и, соответственно, различной разности потенциалов. Последнее обусловлено неодинаковой энергией связи ион-атомов в кристаллической решетке и различной способностью к гидратации у отдельных металлов. Цинк, например, обладает большей способностью посылать ионы в раствор, чем „медь, поэтому он приобретает более высокий отрицательный заряд. Если пластинки цинка и меди, погруженные в растворы своих солей (рис.2), соединить проволокой, то различие в значениях их потенциалов приведет к переходу соответствующего числа электронов с цинковой пластины на медную. Это нарушит равновесие двойного электрического слоя на обеих пластинах. С цинковой пластины некоторое число ионов Zn++ вновь перейдет в раствор, а на медной пластине разрядится соответствующее число ионов Сu++. Таким образом, в зарядах пластинок снова возникает разность, вызывающая направленный переход электронов с цинковой пластины на медную , т. е. электрический ток . Цинковая пластина при этом растворяется, а на медной разряжаются ионы и выделяется металлическая медь. Следовательно, одной из причин возникновения ЭДС в гальванических элементах являются различные значения потенциалов, возникающие у отдельных металлов на границе металл-раствор. Возникновение ЭДС в гальванических элементах связано также с контактной разностью потенциалов, возникающей на границе соприкосновения двух металлов. Образование последней вызвано различной концентрацией свободных электронов (электронного газа) у отдельных металлов, поэтому при контакте часть электронов переходит от металла с более высокой их концентрацией „ к металлу с меньшей концентрацией.
Рассмотренное позволяет установить общие условия, необходимые для построения любого гальванического элемента :
а) наличие проводников первого рода (электронная проводимость) и второго рода (ионная проводимость);
б) возможность разделения системы на две неравноценные, чем-либо отличающиеся (физически, химически ,механически) части, иначе говоря, в гальваническом элементе должна существовать мысленная возможность проведения плоскости ассиметрии;
в) система должна быть неустойчивой, метастабильной, т.е.склонной к изменению. Например, металлы, погруженные в растворы своих солей, склонны .к выделению того или иного количества ионов.
Узнать действительную разность потенциалов между металлом и раствором пока не удалось. Обычно измеряют относительные по- тенциалы металлов, принимая условно за нуль значение потенциала нормального водородного электрода (рис.4).
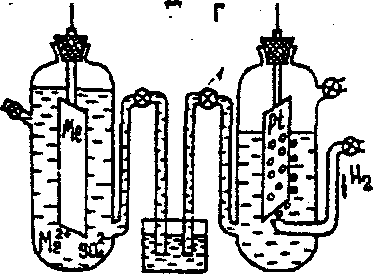
Рис.4.
Схема определения электродного потенциала Водородный электрод представляет собой платиновую пластинку, покрытую тонким слоем рыхлой пористой платины (для увеличения поверхности электрода). Эта пластинка опущена в 2 Н водный раствор Н2SO4 (СH+ = 1 М ) . Через раствор Н2SO4 пропускают химически чистый водород под атмосферным давлением. Боковая трубка с краном 1 служит для соединения водородного электрода с другим электродом. Пластинку, поверхность которой насыщена атомарным водородом, можно рассматривать как водородный электрод. (1 объем платины поглощает 600-700 объемов водорода). На границе платины и раствора устанавливается равновесие : H2↔2Н↔2Н++2е
Водородный электрод обозначается: H2 | 2H+
Разность потенциалов между металлом, погруженным в раствор своей соли, содержащей 1 грамм-ион металла в литре, и нормальным водородным электродом называется нормальным (или стандартным)
электродным потенциалом ( Y0Me ). Обычно для измерения стандартного потенциала металла пользуются гальваническим элементом, изображенном на рис.4.Один полуэлемент этого гальванического элемента - металл, опущенный в раствор своей соли (СMe +2 = 1 М), другой - водородный электрод. Электродвижущая сила элемента определяется компенсационным методом. Полуэлементы присоединяются к цепи внешнего источника тока (аккумулятор А) так, чтобы положительный полюс аккумулятора был соединен с положительным полюсом исследуемого гальванического элемента, а отрицательный полюс аккумулятора - с отрицательным полюсом гальванического элемента. Перемещая движок Д добиваются того, что гальванометр Г покажет отсутствие тока в цепи. По величине ЭДС аккумулятора, учитывая соотношение сопротивлений НК и НД, определяют ЭДС элемента:
ЭДС=Y0Me –Y0H
Так как Y0H=0 , то Y0Me=ЭДС. Для активных металлов Y0Me имеет отрицательное значение ,а для неактивных (Сu.Ag.Pt.Аu) - положительное. Располагая металлы по значениям их нормальных электродных потенциалов, получим ряд напряжений металлов. Ряд напряжений является количественной характеристикой известного ряда вытеснительной активности металлов. Из таблицы "Ряд напряжений металлов" вытекают следствия:
1.Каждый предыдущий металл в ряду напряжений вытесняет расположенные за ним металлы из растворов их солей.
2.Только металлы с отрицательными значениями потенциалов способны вытеснять водород из его соединений.
3.Чем левее в ряду напряжений находится металл, тем легче он отдает электроны и тем труднее восстанавливаются его ионы до атомов. Щелочные металлы из их соединений восстанавливаются только при действии самого сильного восстановителя - электрического тока ( в неводных растворах).
4.В гальваническом элементе анодом служит тот металл, который в ряду напряжений характеризуется наиболее отрицательным потенциалом, т.е. более активный металл.
Для расчета ЭДС гальванического элемента необходимую из потенциала электрода с более положительным значением вычесть потенциале менее положительным значением. Например, для вычисления ЭДС медно-цинкового гальванического элемента, когда металлы погружены в растворы их солей с концентрацией ионов 1 грамм-ион/л, надо от нормального потенциала меди +0,34 . В вычесть нормальный потенциал цинка - 0.76 В.
ЭДС = Y0Cu - Y0Zn = 0,34 - (-0,76) = 1,1 В
Y0Cu и Y0Zn - нормальные электродные потенциалы меди и цинка.
Зависимость равновесных электродных потенциалов от концентрации их собственных ионов в растворе выражается формулой Нернста, которая может быть также использована для расчета ЭДС гальванического элемента, когда металлы погружены в растворы их солей с концентрацией ионов больше или меньше 1 г-иона/л.
RT
Y Me = Y0 Me + —— in С .
nF
где Y Me - равновесный электродный потенциал, В,
Y0Me - нормальный электродный потенциал, В,
R - универсальная газовая постоянная, равная 8,316Дж,
Т - температура в градусах абсолютной шкалы,
n - валентность иона металла,
F - число фарадея, равное 96500 кулонов,
С - концентрация ионов металла в растворе в г-ион/л,
При подстановке в формулу Нернста всех констант и температуры, равной 18 градусам Цельсия , она примет вид :
0,059
Y Me = Y0Me + ——— lg С
n
При С= 1 г-ион/л Y Me = Y0Me , т.е. равновесный потенциал становится равным нормальному электродному потенциалу. Формулу Нернста можно применить только к металлам, находящимся в растворах своих солей. Из формулы Нернста видно, что значение равновесного электродного потенциала (Y Me ) зависит от концентрации его ионов в растворе. Следовательно, ЭДС может возникнуть за счет разности концентраций одного и того же электролита, в растворы которого погружены электроды из одного и того же металла (рис.5).
C1 С2
С1>C2
Рис. 5.Схема концентрационного гальванического элемента
ЭДС возникает за счет выравнивания концентраций в различных зонах раствора. Положительный знак - будет иметь электрод, погруженный в раствор большей концентрации, т.к. для выхода в более концентрированный раствор ионы металла будут затрачивать большую работу.
ЭДС такого элемента равняется
RT
( С1 > С2 ) ЭДС=Y1 – Y2 = [ Y0 + —— 1n С1 ]
n F
RT
–– [Y0 + —— 1n C2] =
n F
RT 1
= —— 1n ——
n F С2
Этот элемент будет работать до тех пор, пока не выравняются концентрации обоих растворов и называется он концентрационным гальваническим элементом. Работа (А) любого гальванического элемента может быть определена как произведение электрического заряда q,переносимого грамм-атомом растворяющегося или выделяющегося металла (q=nF, где n - заряд . F - число Фарадея) на ЭДС гальванического элемента (ΔЕ).
А = Δ E nF .
Работа гальванического элемента, работающего в стандартных условиях :А0 = ΔЕ0 nF ,где ΔЕ0 - ЭДС элемента при условии, что все реагенты находятся в стандартном состоянии.
Работа обратимого гальванического элемента соответствует изменению энергии Гибса ΔG :ΔG= -ΔE nF ,ΔG = - ΔЕ0 nF .
В процессе работы гальванического, элемента его ЭДС ,как правило, уменьшается. Это вызвано изменением значений электродных потенциалов' катода и анода при протекании через них электрического тока. Например , при работе элемента Вольта выделяющийся на медной пластине- газообразный водород частично поглощается ею. как бы изолируя электрод от раствора. Тем самым затрудняется дальнейшее разряжение водорода, и на катоде скапливается избы точное количество электронов .Это приводит к смещению потенциала катода в отрицательную сторону (катодная поляризация). Увеличение ионов растворяющегося металла вблизи цинковой пластины сдвигает потенциал анода в положительную сторону (анодная поляризация ) . Изменение потенциалов электродов при работе гальванического элемента называется их поляризацией.
Поляризация электродов приводит к уменьшению ЭДС и препятствует нормальной работе гальванического элемента, поэтому на практике ее стараются устранить .Процесс уменьшения поляризации электродов называется деполяризацией, а вещества или ионы, применяемые для этой цели, - деполяризаторами.
Гальванические. Элементы ,благодаря их малому весу, портативности, простоте конструкции и надежности в работе, нашли широкое применение в технике как химические источники тока. Например, они используются на искусственных спутниках и космических кораблях (серебряно-цинковый элемент), в радиотехнике и т.д.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Определение ЭДС медно-цинкового гальванического элемента.
I. Выполнение опыта проводится на установке. которая изображена на рис.6
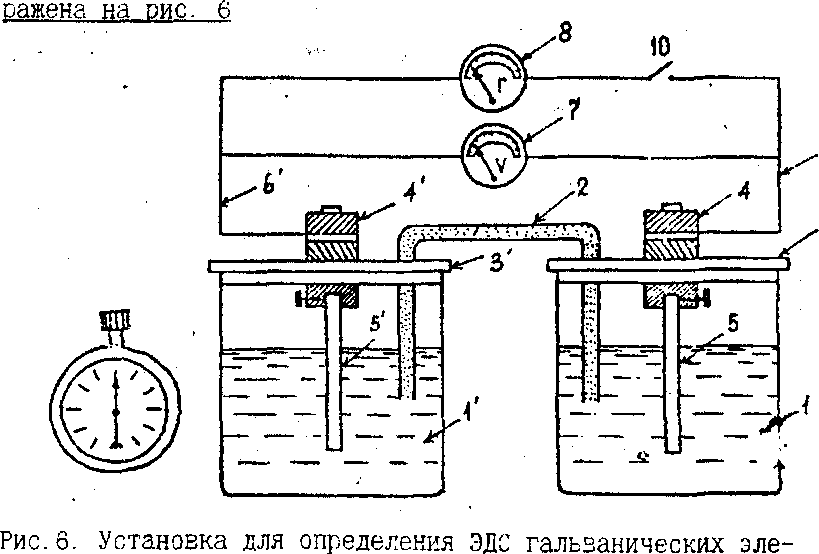
Рис.6.Установка для определения ЭДС гальванических элементов, где:
1,1'- батарейные стаканы, 2 - стеклянная трубка, 3,3'- изолирующие крышки, 4.4'- универсальные клеммы, 5,5'- электроды, 6.6'- провода, 7 - вольтметр, 8 - гальванометр, 9 - секундомер, 10 -выключатель.
1.В батарейный стакан 1 налить ( до 0,5 его объема) 1 М раствор сульфата цинка, а в стакан Г - такой же объем сульфата меди.
2.Закрепить в крышках стаканов с помощью универсальных клемм цинковую и медную пластинки и погрузить их в растворы солей этих металлов.
3.Соединить стаканы U-образной трубкой.
4.Собрать схему (рис.7).Цепь не замыкать.
Г.З.
Рис. 7. Схема включения гальванического элемента.
5.Замкнуть цепь и одновременно включить секундомер. Записать показания вольтметра. Убедиться с помощью гальванометра в наличии тока в цепи.
6.Наблюдать, изменится ли во времени ЭДС? Через пять минут после включения разомкнуть цепь и записать показания вольтметра.
7.Вынуть U-образную трубку и поместить в склянку с концентрированным раствором нитрата калия. Открепить цинковую и медную пластины и промыть их водопроводной водой. Влажные образцы протереть фильтровальной бумагой, очистить наждачной бумагой и вставить в соответствующие гнезда набора "Ряд напряжений металлов".
8.Растворы перелить в соответствующие склянки и ополоснуть стаканы дистиллированной водой.
9.Записать : а)схему гальванического элемента .б) уравнение процесса окисления на аноде, в) уравнение процесса восстановления на катоде. г) суммарное уравнение окислительно-восстановительной реакции.
10.Подсчитать теоретическую величину ЭДС гальванического элемента (величины электродных потенциалов) .Сделать вывод, является ли исследованный гальванический элемент практически поляризующимся.
11.Зарисовать схему работающего медно-цинкового гальванического элемента и указать на ней стрелками направление движения электронов и ионов.
В таком же порядке изучить работу гальванических элементов, заданных преподавателем.
II. Упрощенный вариант выполнения опыта
1.В качестве медного и цинкового электродов используются отрезки медного и цинкового проводов, которые зачищают наждачной бумагой, протирают фильтровальной бумагой И опускают соответственно в пробирки с растворами сульфата меди и сульфата цинка.
2.Пробирки соединяются между собой U- В качестве батарейных стаканов 1 и 1` (рис.6) используются две обычные химические пробирки с широкими раструбами, которые устанавливаются в штативе для пробирок.
В одну из них наливают 1 М раствор Cu SO4 (1/2 объема пробирки) , в другую - 1 М раствор Zn SO4.
3.образной стеклянной трубкой, заполненной электролитом.
4.Внешняя цепь замыкается через комбинированный прибор
Ц 4354 М, который может работать и в режиме миллиамперметра, и в режиме вольтметра. Соединяют универсальными' клеммами ("крокодильчиками") электроды гальванического элемента с соответствующими полюсами измерительного прибора : кнопка режима работы включена в положение "—" - постоянный ток, кнопка замыкания цепи выключена.
5.Вращающийся вокруг оси переключатель режима работы прибора ставится в положение "V" - вольтметр на интервал показаний
1,5- 6 В. Включается кнопка замыкания на приборе и измеряется напряжение в цепи ( верхняя шкала "V,А")Это есть ЭДС начальная
гальванического элемента.
6.Переключается режим работы прибора на мА" - миллиамперметр, пределы измерений - 3 мА. Измеряется ток в цепи ( по той же шкале ,по которой измерялось напряжение), одновременно начинается отсчет времени работы гальванического элемента.
7.Через 10-15 минут после начала отсчета переключатель снова ставится на режим "V" и измеряется ЭДС конечная.
Изменилась ли ЭДС в процессе работы гальванического элемента ? Сделать вывод о практической поляризуемости элемента.
8.Зарисовать схему работающего медно-цинкового элемента и указать на ней направление движения электронов и ионов.
9.Разобрать цепь. Вынуть U-образную трубку из пробирок и поместить ее в' склянку с концентрированным раствором нитрата калия. Вылить электролиты из пробирок в те же склянки, откуда их брали. Промыть пробирки и электроды водопроводной, а. затем дистиллированной водой, протереть электроды фильтровальной бумагой.
10.Записать уравнения окислительно-восстановительных процессов, протекающих на электродах.
11.Подсчитать теоретическую величину ЭДС гальванического элемента.
12.Расчитать относительную погрешность опыта ,используя формулу:
+ ЕТЕОР.- ЕЭКСПЕР.
% от. = ———————— * 100%
- ЕТЕОР.
( Еэкспериментальное – ЭДС начальное Г.Э.)
13.В таком же порядке изучить работу гальванических элементов, заданных преподавателем.
Примечание и меры предосторожности
В данной работе используются растворы сульфата меди и цинка. При работе с ядовитыми веществами (CuSO4 , ZnSO4 ) необходимо соблюдать максимальную осторожность. Наливая эти жидкости в реакционные сосуды, нужно следить ,чтобы не пролить их на руки или на стол. После работы тщательно убрать рабочее место и вымыть руки с мылом.
ЛАБОРАТОРНАЯ РАБОТА
КОРРОЗИЯ МЕТАЛЛОВ
ЦЕЛЬ РАБОТЫ : ознакомить студентов с некоторыми видами электрохимической коррозии, встречающимися в практике, в быту. Закрепить их знания путем проведения самостоятельной экспериментальной работы по коррозии и анализа полученных результатов.
ПРОГРАММА К КОЛЛОКВИУМУ
1.Что называется коррозией металлов?
2.Что представляет собой химическая коррозия ?
3.В чем суть электрохимической коррозии? Причины возникновения электрохимической коррозии.
4.Основная схема электрохимической коррозии, анодное окисление металлов и катодная деполяризация.
5.Коррозия металлов под каплей воды. Указать катодный и анодный участки. Записать процессы, протекающие на катодном и анодном участках металла.
6.Катодное и анодное покрытие металлов. Записать процесс коррозии во влажном воздухе при нарушении целостности покрытия оцинкованного железа. Указать, что при этом является катодом, а что анодом.
7.Как будет протекать коррозия латуни в кислой среде? Что будет является катодным, а что анодным участком? Записать схематически процессы на катоде и аноде.
Теоретические основы метода выполнения работы
Технически нецелесообразное разрушение металлов под воздействием внешней среды называется коррозией. Ржавление - частный случай коррозии, когда разрушению подвергаются черные металлы, т.е. железо и его сплавы.
В зависимости от характера среды, с которой взаимодействует металл, различают два вида коррозии - химическую и электрохимическую. Такое деление удобно при практическом рассмотрении процессов коррозии, хотя и является условным.
При химической коррозии разрушение металла происходит за счет химической реакции в средах, не проводящих электрический ток. К химической коррозии относится разрушение металлов в сухих газах и парах при высокой температуре в отсутствии влаги (газовая коррозия) или в жидкостях, не проводящих электрического тока (коррозия не в электролитах) .Появление слоя окалины на деталях двигателя внутреннего сгорания, лопатках газовых турбин, металлах после обработки - есть результат протекания химической коррозии. При высоких температурах на поверхности металла протекает процесс :
2 Me(ТВ.) +O2 ↔ 2 МеО
МеО(ТВ.) → [ МеО] - раствор оксида в металле.
Химическая коррозия в неводных средах протекает при эксплуатации химико-технологического оборудования. В ее основе лежат обычные гетерогенные реакции :
2 R - CI + Me → MeCl2 + R – R ,
R1
S + Me → Me + R1 – R2
R2
( R - органический радикал )
По типу второй реакции протекает коррозия стальных резервуаров - хранилищ нефти, в которой находится большое количество сернистых соединений.
Так корродируют плунжерные пары, форсунки двигателей внутреннего сгорания, работающие на топливе с примесями сернистых соединений.
Если металл при высоких температурах попадает в восстановительную атмосферу (например, пары воды), то может протекать процесс:
Fe + Н2О →Fe O + Н2
Fe O → [ Fe O ] Н2 —> 2 [Н] .
Как Fe O , так и Н 2 диффундируют вглубь металла, водород создает при этом повышенную хрупкость металла, что снижает его прочность.
К электрохимической коррозии, которая имеет более широкое распространение, относится разрушение металлов в средах, проводящих электрический ток, - в растворах электролитов, во влажной атмосфере с растворенными в ней газами, в почве и т.п.
Согласно теории микропар , причиной электрохимической коррозии металлов является наличие на их поверхности микроскопических короткозамкнутых гальванических элементов, возникающих вследствие неоднородности металла и его контакта с окружающей средой. В отличие от специально изготовленных в технике гальванических элементов они возникают на поверхности металла самопроизвольно.
На поверхности любого металла, находящегося в атмосфере, всегда существуют условия для построения гальванического элемента. В тонком слое влаги, всегда существующем на поверхности металла, растворяются углекислый, сернистый и другие газы, присутствующие в воздухе. Это создает условия для соприкосновения с электролитом.
С другой стороны, различные участки поверхности данного металла обладают разными потенциалами. Причины этого - многочисленны, например, разность потенциалов между различно обработанными частями поверхности, разными структурными составляющими сплава, примесями и остальным металлом и т.д. При этом, очевидно, участки поверхности образца металла с более электроотрицательным потенциалом становятся анодами и растворяются.
При конструировании металлических изделий необходимо Всегда учитывать угрозу их электрохимической коррозии, особенно, когда имеется контакт между металлами, стоящими в ряду напряжений на значительном расстоянии друг от друга. Не иногда при изготовлении изделий из листового алюминия, (например, шасси в радиотехнике) используются медные заклепки, которые могут играть роль катодов, а алюминий - роль анода. В этом случае он будет разрушаться. Сочетания металлов ,сильно отличающихся значениями электродных потенциалов, в технике не допустимы. Если имеется контакт какого-либо металла со сплавом и возникла коррозия, тс сплав приобретает потенциал, соответствующий значению наиболее отрицательного металла, входящего в его состав. При контакте латуни с железом корродировать станет латунь (за счет наличия в ней цинка). Очень часто электрохимическая коррозия возникает в результате различной аэрации, т. е. неодинакового доступа кислорода воздуха к отдельным участкам поверхности металла. На рис.1 изображен случай коррозии железа под каплей води.
Рис.
1 . Схема коррозии железа под каплей
воды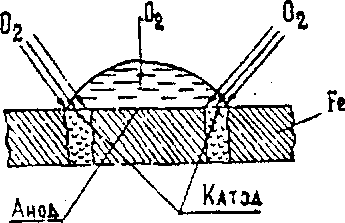
Около краев капли, куда кислороду проникнуть легче, возникают катодные участки. В центре, где толщина слоя воды больше и кислороду проникнуть труднее - анодный участок.
Поскольку электрохимическая коррозия обусловлена деятельностью микрогальванических элементов, можно сделать общий вывод, что все факторы, способствующие деятельности этих элементов, усиливают коррозию. Такими факторами являются : значительная ЭДС, небольшая поляризация, высокая электропроводность раствора.
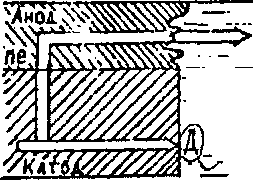
Рассмотрим работу электродов микрогальванического элемента, находящегося на поверхности металла при коррозии последнего в электролите (рис.2).
 Металл
Электролит
Металл
Электролит
Men+ + m H2O
Водородная деполяризация
H+ + ē = H; H + H = H2
Кислородная деполяризация 2H2O+O2+4ē =4OH‾
Рис. 2. Схема электрохимической коррозии ; Д - деполяризатор
На анодном участке, потенциал которого электроотрицательнее, происходит растворение металла, которое схематически может быть записано так :
M n+ * nē + m Н2O=M * H2O + nē
Часть освободившихся электронов перейдет с анода на катод в направлении, показанном стрелкой на рисунке. Поляризация электродов, однако, препятствует протеканию процесса коррозии, т. к. электроны, оставшиеся на аноде образуют с перешедшими в раствор положительными ионами двойной электрический слой ,и растворение металла прекращается. Следовательно , электрохимическая коррозия может протекать ,если электроны с анодных участков постоянно отводятся на катодные и затем удаляются с катодных участков. Процесс отвода электронов с катодных участков при электрохимической коррозии называется деполяризацией ,а вещества или ионы, применяемые для этого - деполяризаторами.
На практике наиболее часто встречаются два вида деполяризации (рис.2),при которых происходит связывание электронов на катодных участках, - это коррозия с водородной деполяризацией (1) и коррозия с кислородной деполяризацией (2) :
H++ ē = Н Н + Н = Н2 (1)
2 Н2 О + О2+ 4ē = 4 OH‾ (2)
Реакция (1) имеет место на катодных участках при протекании процесса электрохимической коррозии металла в кислой среде ,реакция (2) - в нейтральной .Ионы воздуха в реакции (1) и молекулы растворенного кислорода в реакции (2) выполняют роль деполяризаторов. Особенно широко распространен процесс коррозии с кислородной деполяризацией. Он наблюдается при коррозии металлов в воде, почве и т. д.Примером может служить ржавление железа во влажном воздухе. Составляющий сплава Fe3С имеет более электроположительный потенциал и является катодом, чистое железо большее отрицательный потенциал - анод.
На аноде 2Fe - 4ē = 2 Fe++
На катоде 2Н2O + O2 + 4ē = 4 ОН‾
В итоге : 2 Fe++ + 4 (ОН)‾ = 2 Fe(OH)2
4 Fe(ОН)2 + 2 Н2O + O2 =4 Fe(ОН)3
Основная масса черных металлов разрушается вследствие протекания этих реакций. Причиной коррозии металлов в почве также может быть различная аэрация кислорода к различным участкам поверхности металла. Если трубопровод, заложенный в землю, проходит через участки почвы, различные, по составу и плотности (песчаные, глинистые, болотистые). то коррозии будет подвергаться тот участок трубопровода, который находится в более плотном слое - глине (рис.3).
N2O O2
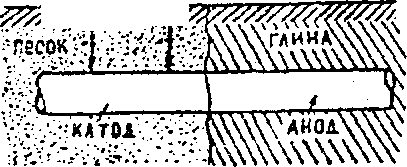
Рис.3. Коррозия в почве
Анод Fe - 2ē = Fe2+
Часть трубопровода, находящаяся в песке, будет являться при этом катодом, т.к. через слой песка к поверхности трубопровода легче, доступ кислорода и воды :
Катод : 2 Н2O + O2 + 4ē = 4 ОН‾
Для защиты от коррозии в этом случае применяется электрохимическая защита, чаще катодная. Она сводится к присоединению защищаемой части трубопровода к отрицательному полюсу внешнего источника тока (рис.4),в результате чего на защищаемом металле создается высокий электроотрицательный потенциал. Положительный полюс внешнего источника соединяется с металлоломом, который и подвергается разрушению. Радиус действия аккумуляторной батареи при катодной защите велик - до 50 км.
Металлолом
Рис.4. Схема катодной защиты
Коррозионные пары могут возникать при действии внешних или внутренних напряжений (остаточных напряжений при сварке).
Если пластинку из стали, дюраля или титанового сплава согнуть в напряженном состоянии и погрузить в коррозионную среду (рис.5),то на растянутом слое будут возникать трещины, а внутренний слой будет оставаться без изменений. Коррозия под напряжением приводит к транскристаллитному растрескиванию металла, поэтому при изготовлении деталей и узлов машин для снятия остаточных напряжений их подвергают термической обработке, если они предназначены для работы в коррозионных средах.
—~
—'~-3»ЕХТР0АМТ~-
Рис.5.
Коррозия
пластины в напряженном состоянии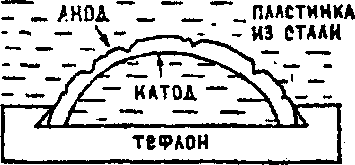
Большую роль в процессах подземной коррозии металлов играют блуждающие токи т.е. токи посторонних источников (линии электропередач). Очень часто источниками блуждающих токов является электрический рельсовый транспорт.
Рассмотрим коррозионное разрушение трубы или кабеля, заложенного в почву, под действием утечки тока с трамвайного рельсового пути (рис.6).
Рис.
6.
Коррозия
под действием
блуждающих
токов.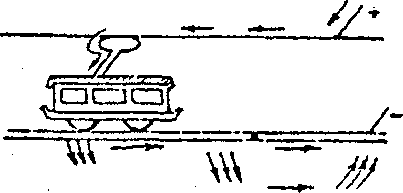
На стыке рельсов, где сопротивление максимальное, а электропроводность почвы большая, часть тока уходит в землю, встречает трубопровод и, пройдя через него, снова уходит в линию. Участок трубопровода ,куда поступает ток, - катод, участок, откуда ток уходит в линию' - анод (он разрушается).Коррозия под действием блуждающих токов часто приводит к полному разрушению заложенных в землю сооружений.
1
- гальванометр, 2 - угольные наконечники,
3 - металлическая пластинка, 4 - провода
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОПЫТ 1. Опытное обнаружение микрогальванических элементов на поверхности металла
Рис.
7. Установка для экспериментального
обнаружения микрогальванических
элементов на поверхности
металла: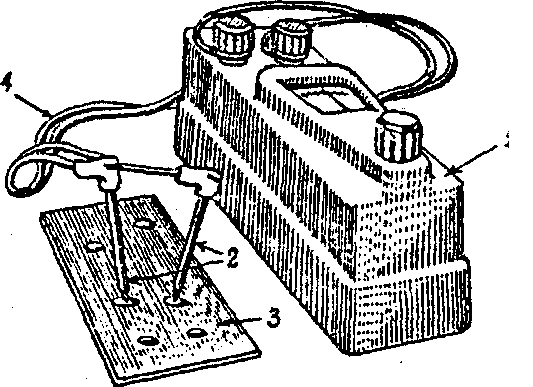
1.Три металлические пластинки (железную, алюминиевую, магниевую) тщательно зачистить наждачной бумагой, промыть водопроводной водой и высушить Фильтровальной бумагой.
2.На поверхность всех пластинок нанести в разных местах пипеткой несколько капель 3 % -ного раствора хлористого натрия. По очереди прикасаясь к поверхности каждой пластинки, в местах нанесения капель угольными наконечниками, которые соединены со стрелочным гальванометром (рис.7),можно обнаружить появление электрического тока.
Промыть пластинки под краном и протереть фильтровальной бумагой. Почему возникает электрический ток? Чем объяснить наличие на поверхности металла участков с различными значениями потенциалов? Сделать рисунок установки. Записать электродные процессы, протекающие в образующихся микрогальваноэлементах на каждой из пластин. В каком случае отклонение стрелки гальванометра максимальное? Почему?
ОПЫТ 2. Электрохимическая коррозия при контакте двух металлов
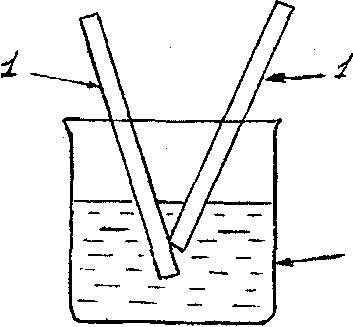
Рис.8. Установка для наблюдения процесса коррозии при контакте двух металлов, где: 1,1' - стержни . 2 - стакан с раствором серной кислоты
1. В стеклянный стакан (рис.8) (1/2 объема) налить 0,01 Н раствор серной кислоты.
2.Опустить в стакан цинковый стержень. Наблюдать медленное выделение водорода.
3.Опустить в стакан медный стержень так, чтобы он не соприкасался с цинковым . Наблюдается ли выделение водорода на медном стержне?
4.Привести в контакт медный и цинковый стержень в растворе кислоты. Объяснить выделение водорода на меди в этом случае. Составить схему работы образовавшейся гальванопары. Как повлиял контакт с медью на скорость коррозии цинка?
5.После окончания опыта вынуть стержни из стакана, промыть дистиллированной водой и высушить фильтровальной бумагой. Содержимое колбы перелить в соответствующую склянку.
Что станет корродировать при контакте железа с медью?
ОПЫТ 3. Образование микрогальванопар
1.Поместить в пробирку кусочек гранулированного цинка и прилить в нее несколько миллилитров разбавленной серной кислоты. Обратить внимание на медленное выделение водорода.
2.Прилить в ту же пробирку несколько капель раствора сульфата меди. Чем объяснить энергичное выделение пузырьков водорода ? Написать уравнение реакций и электронные схемы наблюдаемых процессов.
3.После окончания опытов содержимое пробирок вылить в специальную склянку, находящуюся в вытяжном шкафу. Пробирку ополоснуть дистиллированной водой.
ОПЫТ 4. Термическое оксидирование стали
1.Стальную пластинку тщательно очистить наждачной бумагой.
2.Зажав один конец пластинки держателем, другой поместить над пламенем газовой горелки. Нагревать пластинку до появления цветов побежалости, т. е. до образования тончайших окисных пленок. Эти пленки ввиду неодинаковой толщины вызывают различную интерференцию света и поэтому окрашены в различные цвета.
3.Вынуть пластинку из пламени и охладить.
4.По всей длине пластинки, начиная от края, примерно на равном расстоянии, нанести три капли 0,01 н раствора сульфата меди.
5.По скорости выделения меди оценить защитные свойства
полученной пленки. Написать уравнение происходящей реакции. В результате какого типа коррозии (химической или электрохимической) образуется окисная пленка на стальной пластинке?
ОПЫТ 5. Коррозия в результате неравномерного доступа кислорода
1.Стальную пластинку тщательно очистить наждачной бумагой, промыть водопроводной водой и высушить фильтровальной бумагой.
2.На поверхность пластинки пипеткой нанести каплю раствора содержащего хлорид натрия, красную кровяную соль и фенолфталеин. Наблюдать синее окрашивание в центре капли и розовое - у ее краев. Чем вызвано появление различной окраски капли? Пояснить с помощью соответствующих уравнений реакций.
Примечание и меры предосторожности
1.При работе с ядовитыми (Cu SO4 ) и агрессивными (Н2 SO4 ) веществами соблюдать максимальную осторожность. Наливая эти жидкости в реакционные сосуды. нужно следить, чтобы не пролить их .на стол и на руки; По окончании опыта вылить эти жидкости в исходные сосуды и вымыть руки с мылом.
2.При попадании кислоты на кожу необходимо пораженный участок смыть струей воды, а затем обработать 3-5 % раствором питьевой соды.
ЛАБОРАТОРНАЯ РАБОТА
ЭЛЕКТРОЛИЗ И ГАЛЬВАНИЧЕСКИЕ ПОКРЫТИЯ МЕТАЛЛОВ
ЦЕЛЬ РАБОТЫ: научить студентов разбираться в процессах электролиза водных растворов и расплавов солей и щелочей. уметь писать уравнения электрохимических процессов, протекающих на электродах, научить студентов в лабораторных условиях самостоятельно получать катодные покрытия и правильно объяснять протекающие при этом явления.
ПРОГРАММА К КОЛЛОКВИУМУ
1.Что называется электролизом?
2.Что называется напряжением разложения? Перенапряжение при электролизе?
3.Электролиз растворов солей с нерастворимыми электродами:
а) записать схематически электролиз воды на катоде и аноде:
б) чему равен потенциал окисления вода на аноде и восстановления воды на катоде?
в) какова последовательность разряда катионов на катоде при электролизе растворов солей?
г) какова последовательность разряда анионов на аноде при электролизе водных растворов солей с нерастворимым анодом?
д) записать процесс электролиза водного раствора Сг (N03 )3 ,CuSO4 на нерастворимых электродах.
е) как протекает электролиз расплавов солей и щелочей? Записать уравнения электролиза расплавов NaOH , Na2 SO4 , NaCl.
4.Электролиз растворов солей с растворимыми электродами:
а) записать процесс электролиза водного раствора сульфата никеля с никелевым анодом;
б) записать процесс электролиза сульфата меди из электролита, содержащего соль CuSO4 и серную кислоту, с медным анодом.
5. Законы Фарадея :
а) первый закон, второй закон, объединенный закон; дать формулировки и записать их математически;
б) найти эквивалент олова, зная, что при токе силой 2,5 А из раствора SnCl2 за 30 минут выделяется 2,77 г олова;
в) какой объем водорода, измеренный при нормальных условиях, выделится на катоде, если пропустить через раствор NaCl ток силой 2 А в течение 20 минут?
Теоретические основы метода выполнения работы
Электролизом называется химическое действие электрического тока. При электролизе имеют место те же окислительно-восстановительные процессы, которые протекают у электродов при работе гальванического элемента (см. работу Г.Э.). Разница между ними заключается в том, что для проведения электролиза используется внешний источник тока.
Анодное окисление и катодное восстановление составляют основу электролиза.
Для непрерывного протекания электролиза на электродах необходимо поддерживать определенное напряжение электрического тока. Наименьшее напряжение, при котором возможен электролиз, называется напряжением разложения данного электролита.
При электролизе электрическая энергия превращается в химическую , в гальванических элементах, наоборот, имеет место превращение химической энергии в электрический ток. Отсюда следует, что для проведения электролиза теоретически было бы достаточно напряжение, численно равное ЭДС гальванического элемента, составленного из этих электродов, но имеющего противоположное направление. Однако в практике, в большинстве случаев, напряжение разложения оказывается большим, чем ЭДС соответствующего гальванического элемента.
Разность между напряжением разложения, фактически необходимым для проведения электролиза, и ЭДС гальванического элемента, составленного из этих электродов, называется перенапряжением при электролизе и обозначается буквой h :
h = Ер + Е ЭДС, где
Ер - напряжение разложения
Е ЭДС - ЭДС гальванического элемента, отвечающего этой системе
Для каждого электрода установлено значение выделительного потенциала иона. Выделительным потенциалом называется тот минимальный потенциал на электроде, при котором начинается фактический разряд ионов. Выделительный потенциал на небольшую величину превышает равновесный потенциал (последний расчитывается по формуле Нернста).
Протекание электролиза существенно зависит от природы материала анода. Электролиз может проводиться с применением нерастворимых или 'растворимых анодов. Нерастворимые аноды при электролизе не разрушаются, а служат лишь передатчиком электронов. К ним относится - платина, иридий, графит, уголь. Растворимые аноды при электролизе разрушаются.
Очередность разряда ионов при электролизе рассмотрим на примере электролиза водного раствора Na2SO4 с нерастворимыми (платиновыми) электродами (рис.1).
Сульфат
натрия в водном растворе диссоциирует
по схеме :
Рис.
1. Схема электролизера для электролиза
раствора Na2
SO4
.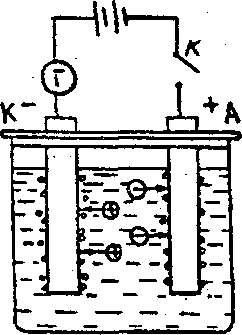
Na2 SO4 ↔ 2 Na+ + SO2-4
Кроме того, в процессе электролиза могут принимать участие. молекулы воды, которые слабо диссоциируют по схеме :
H2O ↔ H+ + OH‾
Так как концентрации ионов, водорода и гидроксила очень малы, фактически в электрохимических процессах , протекающих при электролизе, участвуют молекулы воды, способные ориентироваться у электродов полюсами (положительным - к катоду, отрицательным - к аноду).
У катода ориентируются катионы Na+ и Н2O.
У анода ориентируются анионы SO2-4 и Н2O.
Потенциал восстановления воды на катоде (Y0 ) равен -0,83 В.а стандартный потенциал восстановления иона Na+ равен - 2,71 В.
На катоде первоначально разряжается тот ион, который характеризуется наибольшей величиной электроположительного потенциала. Так как перенапряжение металлов при электролизе невелико, то очередность разряда их ионов может быть установлена с помощью ряда напряжений.
Итак, при электролизе водного раствора сульфата натрия на катоде идет процесс, восстановления воды и защелачивание прикатодного пространства:
2Н2O +2ē=2 0Н‾ + Н2
2ОН‾ + 2 Na+ = 2 NaOH . Такие же катодные процессы имеют место при электролизе водных растворов солей калия, кальция, магния, алюминия и других металлов, электродный "потенциал которых менее - 0,83 В. В этих случаях на катоде выделяется не металл, а водород.
На аноде, в первую очередь, протекает тот процесс, который характеризуется наибольшей величиной электроотрицательного стандартного потенциала. При электролизе водного раствора сульфата натрия стандартные потенциалы окисления ориентирующихся у анода ионов S2-4 ( 2 SO2-4 – 2ē → S2O2-8 ) и молекул воды равны : Y0 = + 2.01 В , Y0 = + 1.23 В.
SO2-4 H2O
Следовательно, на аноде будет протекать процесс окисления воды с выделением кислорода и закислением прианодного пространства:
2Н2O - 4ē = 4Н+ + O2
В общем случае при разряде анионов наблюдается такая закономерность: при электролизе водных растворов солей бескислородных кислот разряжаются анионы J-, Br-, С1-, S- (кроме фторидов), а не молекулы воды.
Например: 2 Сl‾ - 2ē = С12
При электролизе же водных растворов солей кислородосодержащих кислот на аноде окисляются молекулы воды с выделением кислорода, а не ионы:
SO2-4 , РО3-4 , NO‾3 и т.д.
Электролиз с нерастворимым анодом широко используется в технике для получения металлов ( Na, Al, Mg и др.),газов (O2,С12 ).
При электролизе с растворимым анодом на его поверхности могут происходить следующие электрохимические реакции :
1. Анодное растворение металла : Me0 - 2ē = Me++
Например ,электролиз водного раствора Ni SO с никелевым анодом:
Ni SO4 ↔ Ni2+ + SO2-4
Катод ; Ni2+ ,H2O
Y0 = - 0,25В , Y0 = - 0,83В
Ni2+/Ni H2O
В основном происходит разряд ионов Ni2+
Ni2+ + 2ē = Ni0
Ему сопутствует процесс :
2H2O + 2ē = H2 + 2 OH‾
Анод : SO2-4 , H2O , Ni0
Y0 = + 1,23B , Y0 = - 0,25B
H2O Ni/Ni2+
Наиболее электроотрицателен потенциал никеля, поэтому идёт процесс : Ni0 – 2ē = Ni2+
В данном случае процесс сводится к растворению металла анода и выделению его на катоде.
В соответствующих условиях процесс окисления металла на аноде приводит к образованию гладкой. блестящей поверхности, в технике он называется электрополировкой .
2. Образование окисных пленок на аноде :
Me2+ + 2 ОН‾ = МеО + Н2О
Процесс имеет место при анодном окислении меди, алюминия, железа и других металлов. Например, анодное окисление алюминия в растворе Н2SO4 (в качестве растворимого анода завешивается алюминиевая деталь) протекает по следующей схеме :
H2SO4↔ 2 Н+ + SO2-4
Катод : Н+ 2 Н+ + 2ē → Н2
Анод : А10 , SO2-4 , Н2 О ,
Y0 = - 1,66 В , Y0 = + 1,23 В ,
Al/Al3+ H2O
Al0 – 3ē → Al3+
2 Al3+ + 6 OH‾ = Al2O3 + 3 H2O
3. Выделение на аноде газообразного кислорода:
4 ОН‾ – 4ē = 2 Н2O + О2
Такие процессы могут иметь место на аноде при электролизе водных растворов или расплавов щелочей. Например, электролиз водного раствора NaOH : NaOH ↔ Na+ + OH‾
Катод : Na , H2O ,
Y0 + = - 2,7 B , Y0 = - 0,83 B ,
Na/Na H2O
2H2O - 2ē = H2 + 2 OH‾
Анод : OH‾ , H2O ,
Y0 = + 0,4В , Y0 = + 1,23 В ,
OH‾ H2O
4 OH‾ - 4ē = 2 H2O + O2
4. Окисление различных веществ ,находящихся в растворе
Электролиз же расплавленных веществ от электролиза растворов отличается тем ,что в расплаве нет молекул растворителя и электролизу могут подвергаться лишь ионы расплавленного электролита. Например, электролиз расплава NaOH протекает по схеме :
NaOH ↔ Na+ + ОН‾
Катод: Na+ Анод: ОН‾
Na+ + 1ē = Nа0 , 4ОН‾ - 4ē = 2Н2O +O2
В практике электролиз наиболее широко используется для получения гальванических покрытий. Они наносятся для защиты изделий от коррозии (цинкование , кадмирование), для придания им красивого внешнего вида (никелирование).увеличения твердости поверхностного слоя (хромирование),создания поверхности с большей электропроводностью, (серебрение, золочение) и т.п.
Высококачественные гальванические покрытия получаются при электролизе, протекающем с высокой катодной поляризацией (см. работу Г. Э.). Это объясняется тем, что кристаллизация металлов на катоде происходит в две стадии : сначала образуются центры кристаллизации (кристаллические зародыши), а затем они растут до кристаллов той или иной величины. Чем больше скорость возникновения центров кристаллизации, по сравнению со скоростью роста отдельных кристаллов, тем более мелкокристаллической будет структура гальванического осадка. Катодная поляризация, т.е. избыточное количество электронов на катоде, создает условия для увеличения скорости разряда ионов металла и возникновения большего числа центров кристаллизации. Протекание гальванических процессов зависит и от рН раствора. При низких значениях рН раствора возникает возможность восстановления да катоде ионов Н+ вместо катионов металла, и будет выделяться водород. Выделение водорода нежелательно, так как он обладает способностью растворяться во многих металлах и вызывать их наводораживание. При значениях рН раствора 6-7 в результате гидролиза образуются малорастворимые соединения (основные соли, гидраты окисей металлов), которые переносятся на катод и приводят к получению осадков с темными пятнами ( с "загаром"). Поэтому для большинства применяемых на практике электролитов "установлено, что значение их рН должно быть в пределах 3,8-5,2.
Количественно процессы электролиза подчиняются законам Фарадея :
1 Закон : Весовые количества выделяющихся при электролизе веществ пропорциональны количеству прошедшего через раствор электричества и не зависят от каких-либо других факторов.
m = kIt , ( 1 )
где: m-количество вещества в граммах, выделившееся в
процессе электролиза, I - сила тока в амперах, t - время электролиза в секундах, k - электрохимический эквивалент.
Из уравнения (1) при 1= 1 А и t= i сек. , имеем К=m
Электрохимическим эквивалентом называется весовое количество вещества, выделившегося на электроде при прохождении через раствор 1 кулона электричества.
(
2 )
m1 хЭ1
=
m2 хЭ2
где : m1 и m2 - весовые количества выделившихся при электролизе веществ,
хЭ1 и хЭ2 - соответственно их химические эквиваленты
Из уравнений (1) и (2) получаем :
хЭ1 К1
= ( 3 )
хЭ2 К2
Между электрохимическим эквивалентом и химическим эквивалентом существует следующее соотношение :
хЭ1 хЭ2 хЭn
= = …….. = = 96500 кулонов . ( 4 )
К1 К2 Кn
Подставляя в уравнение (1) значение К из уравнения (4) получим
хЭ * It
m = ( 5 )
96500
Отношение веса металла ,осаждающегося на катоде ( m' ), к теоретическому ( m ) называется выходом по току и обозначается буквой ( μ ). Выход по току обычно выражается в %:
m`
μ = * 100 % .
m
Неполный выход металла по току является результатом одновременного разряда на катоде ионов металла и водорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОПЫТ 1. Получение цинкового покрытия и определение выхода по току
1.Поверхность железного образца тщательно зачистить наждачной бумагой , ополоснуть дистиллированной водой и высушить фильтровальной бумагой.
2.Измерить с обеих сторон площадь покрываемого образца. Рассчитать силу тока в цепи, необходимую для получения заданной преподавателем катодной плотности тока.
3.Налить в батарейный стакан или кювету 1/2 объема электролита для цинкования ( состав : ZnSO4 * 7Н2O - 215 г/л,
А12 (SO4 )3 * 18Н2O - 30 г/л, Na2 SO4 * 10Н2О - 50 или 100 г/л. декстрин - 10 г/л ).
4.Закрепить образец б изолирующей крышке 2 (рис.1 ) и вставить ее в стакан (при этом электроды погрузятся в электролит).
5.Собрать схему установки (рис. 2 ).не присоединяя ее к источнику тока. Железный образец соединить с отрицательным полюсом внешнего источника тока, цинковые пластины - с положительным полюсом (дать преподавателю проверить схему).
6.Присоединить схему к источнику тока и одновременно пустить секундомер. С помощью реостата установить требуемую силу тока, поддерживая ее в дальнейшем постоянной.
7.Через 25 минут после начала процесса выключить ток, извлечь образец из электролита и открепить от изолирующей крышки. Промыть образец проточной водой, просушить сначала фильтровальной бумагой, а затем 5-10 минут на воздухе (за это время перелить электролит в склянку и разобрать схему).
Рис.
1. Установка для электролиза с растворимыми
анодами: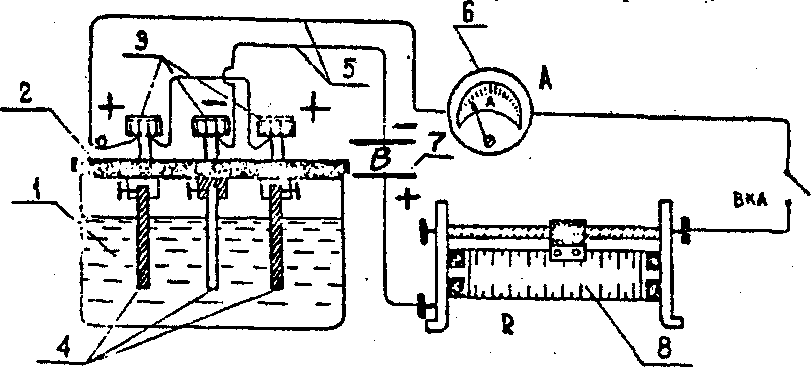
1 - батарейный стакан. 2 - изолирующая крышка,3 - универсальные клеммы, 4 - электроды,5 -провода, 6 - амперметр,7 - выпрямитель,8-ползунковый реостат.
8. Определить толщину покрытия капельным методом согласно прилагаемой методике:
Определение толщины покрытия капельным методом
Для того, чтобы определить толщину цинкового покрытия на железе капельным методом, на поверхность покрытия наносят каплю растворителя ( раствор 200 г/л KI и 100 г/л I2 кристаллического).
Выдерживают 1 минуту, снимают каплю растворителя фильтровальной бумагой и вновь, засекая время, наносят на то же место новую каплю растворителя. Так продолжают до тех пор, пока не появится сплошной участок железа.
Расчет толщины покрытия ( в микронах) производят по следующей формуле : Н = (n- 1).К ,
где n-число капель растворителя, израсходовано на испытание,
К - коэффициент, зависящий от температуры опыта.
t C0 |
100 |
150 |
200 |
250 |
К |
0,78 |
1,01 |
1,24 |
1,45 |
Полученные данные сводят в таблицу. |
||||
Состав электролита |
Число капель рас-ля |
Плотность тока |
Толщина покрытия |
Продолжительность электролиза |
ОПЫТ 2. Электролиз водного раствора сульфата натрия
Опыт проводится на установке (рис. 3),состоящей из U-образной стеклянной трубки 1,наполненной водным раствором сернокислого натрия с небольшим количеством лакмуса, и двух угольных электродов. Электроды закрепляются с помощью пробок 3,в которых сделаны отверстия для выхода газов, выделившихся при электролизе.
1. Включить постоянный ток и пропускать его до изменения окраски раствора у электродов. Наблюдать за выделением пузырьков газа у катода и анода.
2. Выключить ток и составить уравнения процессов, протекающих у электродов. Чем вызвано изменение окраски у раствора?
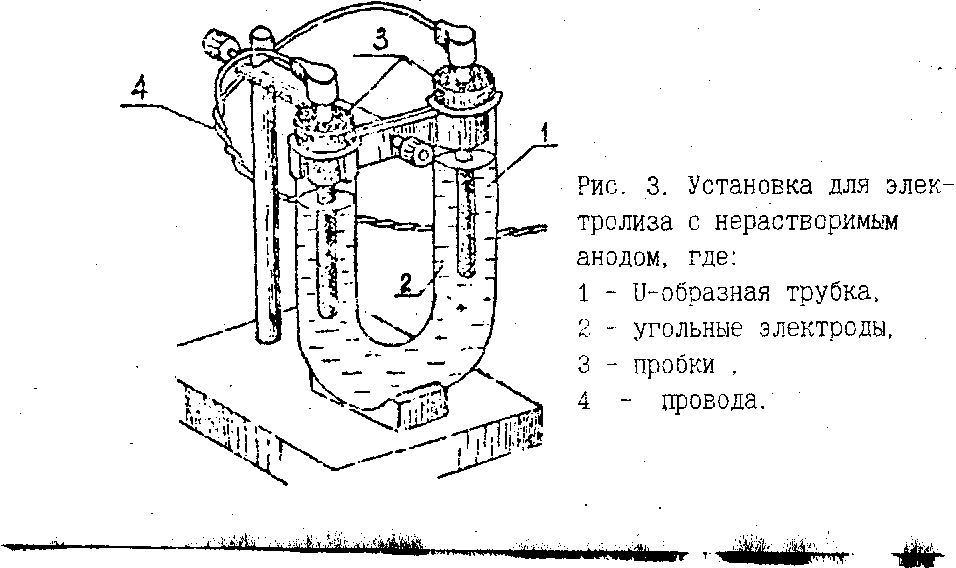
ЛАБОРАТОРНАЯ РАБОТА ГИДРОЛИЗ
ЦЕЛЬ РАБОТЫ : Ознакомление студентов с понятиями гидролиза и константы гидролиза .Освоение навыков работы с индикаторами. .
ПРОГРАММА КОЛЛОКВИУМА
Ионное произведение воды. Понятие о рН. Гидролиз различных солей. Реакция среды в результате гидролиза. Влияние температуры и разбавления на сдвиг равновесия при гидролизе. Константа гидролиза и степень гидролиза.
Теоретические основы выполнения работы
Гидролизом соли называется реакция разложения ее под действием воды. Сущность процесса гидролиза заключается в смещении химического равновесия диссоциации воды под влиянием взаимодействия воды с растворенным веществом. Реакцию самодиссоциации воды можно представить уравнением :
2 Н2O = Н3O++ ОН‾ .
Механизм этого процесса объясняется следующей схемой :
ковалентная связь ионная связь
ионизация диссоциация
H2O ….. H - OH H2O – H+ H‾ H3O+OH‾
водородная связь донорно - акцепторная связь
Присутствие в воде ионов оксония (гидратированных ионов водорода ) Н3O+ и гидроксила ОН‾ придает ей специфические свойства. Так вода может выполнять функции слабой кислоты и слабого основания т.е. является амфолитом. Равновесие между образовавшимися ионами и молекулами воды характеризуется константой диссоциации Кд (квадратные скобки обозначают концентрацию)
[ H3O+] * [ OH‾ ]
Кд =
[Н2О]2
Так как равновесная концентрация воды вследствие ее весьма малой диссоциации практически равна ее общей молярной концентрации ( 55,56 моль/л ), то объединяя постоянную величину [Н2O]2 с Кд, можно записать : КВ или КД = [Н3О+] *[ОН‾] .
Постоянная (при определенной температуре) величина Кв называется ионным произведением воды. Так как концентрация ионов оксония и гидроксила равны между собой и равны 10-7 г-ион/л.то величина КВ равна 10-14 .С повышением температуры количество продиссоциировавших молекул воды увеличивается и величина КВ растет. КВ позволяет расчитать характер среды (кислотность, основность) в водных растворах.
Например, в сантимолярном растворе HNO3 концентрация ионов Н3O+ равна концентрации молекул кислоты ( 10-2 г-ион/л) ,так как HNO3 , являясь сильной кислотой, диссоциирует практически нацело. Тогда концентрация ионов гидроксила ОН‾ составит; 10-14 ; 10-2 = 10-12 г-ион/л.Для кислых растворов справедливо соотношение
[Н3O+] > [ОН‾ ] , а для щелочных (основных) [Н3O+] < [ ОН‾ ]. Характер среды определяют по [Н3О+] .указывая при этом значение рH.рН - десятичный логарифм концентрации ионов водорода в растворе, взятый с обратным знаком :
рН = - lg[H3O+]
В нейтральных растворах рН соответственно равен 7, в кислых меньше 7, а в щелочных больше 7.На практике измерения рН проводят по окислительному потенциалу ионов водорода, зависящему от их концентрации. Для этого используют специальные приборы, называемые рН-метрами. Работа рН-метров основана на преобразовании ЭДС электродной системы, состоящей из измерительного и вспомогательного электродов/в постоянный ток, пропорциональный величине рН. Преобразование ЭДС осуществляется высокоомным преобразователем, основанным на автокомпенсационном принципе действия.
Другой способ оценки рН раствора основан на использовании органических веществ, называемых кислотно-основными индикаторами. Индикаторы меняют свой цвет в зависимости от изменения концентрации ионов Н3O+.Такие органические вещества являются слабыми кислотами или основаниями, молекулы которых (и ионы) имеют различную окраску. Изменение [Н3O+] в растворе сдвигает равновесие их диссоциации в ту или другую сторону, вызывая изменения в соотношении концентраций различно окрашенных частиц. К кислотно-основным индикаторам принадлежат широко известные лакмус, фенолфталеин , метиловый оранжевый.
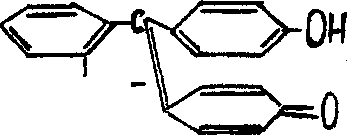
Фенолфталеин представляет собой бесцветные кристаллы, растворимые в спирте. Обычно на практике используется его 0,1 " -ный спиртовый раствор. При действии разбавленных растворов щелочей на фенолфталеин, образуется двунатриевая соль, окрашенная в красный цвет. Реакция протекает согласно уравнению :
0=c — о
бесцветная молекула окрашенный ион
фенолфталеина
Эти структурные изменения в молекуле фенолфталеина происходят при рН= 8-Ю.При действии кислот (при рН<8) наблюдается обратная картина : окрашенная форма переходит в бесцветную. При рН=13-14 фенолфталеин претерпевает новую структурную перегруппировку. При этом образуется трехзамещенная натриевая соль : ОН
Этим объясняется обесцвечивание фенолфталеина при действии большого избытка щелочи.
Метиловый оранжевый (натриевая соль п-диметиламиноазобен- зол сульфокислоты) представляет собой оранжевый порошок. Обычно используется его 0.05 % -ный раствор. Его формула :
В щелочной среде или в сильно разбавленном растворе этот индикатор имеет желто-оранжевую окраску. При действии кислот наблюдается переход окраски в оранжево-красную и красную :
Гидролиз солей
oc-o
Гидролизу могут подвергаться химические соединения различных классов : соли. углеводы, белки, и т. д. В неорганической химии чаще всего приходится иметь дело с гидролизом солей, т. е. с обменным взаимодействием ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды.
Процесс гидролиза сводится, главным образом, либо к связыванию катионами соли гидроксильных групп воды - гидролиз по катиону. либо к связыванию анионами соли ионов водорода - гидролиз по аниону.
Различают типичные случаи гидролиза:
