

35.Граничные орбитали – орбитали в молекуле – самая высокоэнергетическая заселенная орбиталь ВЗМО (заполнена целиком или частично) и самая низкоэнергетическая незаселенная орбиталь НСМО (полностью или частично вакантная). Анализ дает подход к интерпретации реакционной способности в рамках упрощенной теории возмущения МО.
36.Дегалогенирование – отщепление молекулы галогена от молекулы органического соединения.
37.Дегидратация – отщепление воды в реакции элиминирования.
38.Дегидрирование – реакция отщепления водорода.
39.Дегидробензол (арин) – ароматическое соединение с очень высокой реакционной способностью, которое содержит тройную связь. Примером простейшего арина является дегидробензол (бензин).
дегидробензол
40.Дегидрогалогенирование – отщепление гплогеноводорода.
41.Декарбоксилирование – реакция, в результате которой карбоновая кислота теряет диоксид углерода.
42.Дегидрогалогенирование – отщепление галогеноводорода в реакции элимини-
рования.
43.Дезактивирующая группа – заместитель, который делает бензольное кольцо менее реакционноспособным в отношении электрофильного замещения.
44.Делокализованная связь – ковалентная связь, в которой молекулярная орбиталь охватывает более двух атомов. Почти всегда это π-связи.
45.Диен – соединение с двумя углерод-углеродными связями. Для участия в реакции Дильса-Альдера необходимо, чтобы они были сопряженными.
46.Диенофил – соединение, содержащее π-связь, которая обусловливает его взаимодействие с диеном в реакции Дильса-Альдера.

47.Донор электрона – соединение, которое может передавать электрон другому соединению.
48.Е1–реакция – реакция элиминирования, в которой промежуточно образующиеся карбокатионы теряют протон. Отрыв протона происходит от углерода, соседнего с
катионным центром. Эта реакция конкурирует с SN1–реакцией и имеет с ней одну и ту же лимитирующую стадию – образование карбокатиона.
49.Е2–реакция – элиминирование, в процессе которого происходит одновременно отрыв двух групп, преимущественно от соседних атомов. Этот процесс конкурирует с реакцией SN2.
50.Енол – соединение, в котором гидроксигруппа связана с углерод-углеродной двойной связью. Его можно рассматривать как замещенный виниловый спирт. Енолы, как правило, неустойчивы и изомеризуются в таутомерные им соединения с карбонильной группой, называемые кето-формой.
51.Жесткая кислота – кислота Льюиса, акцепторный центр которой имеет низкую поляризуемость. Она связывается с жесткими основаниями скорее, чем с “мягкими основаниями”. Напротив, “мягкая кислота” обладает акцепторным центром с высокой поляризуемостью и проявляет соответствующее предпочтение к “мягкому” партнеру
52.Жесткое основание – основание Льюиса с донорным центром низкой поляризуемости и с вакантными орбиталями высокой энергии. Обратно “мягкому” основанию.
53.Изомеры – соединения с одинаковой молекулярной формулой. Они могут быть разделены на два типа – структурные и стереоизомеры.
54.Имин – производное альдегида или кетона, в котором группа С=О заменена на группу C=N.
55.Индуктивный (индукционный, полевой) эффект – смещение электронной плотности вдоль σ-связей, которое возникает вследствие различия электроотрицательностей атомов, участвующих в этих связях. Благодаря этому эффекту галогены, кислород и азот оттягивают электронную плотность от соседних атомов углерода.
56.Карбанион – отрицательно заряженная частица с тремя заместителями при центральном атоме углерода, имеющем несвязывающую орбиталь с парой электронов
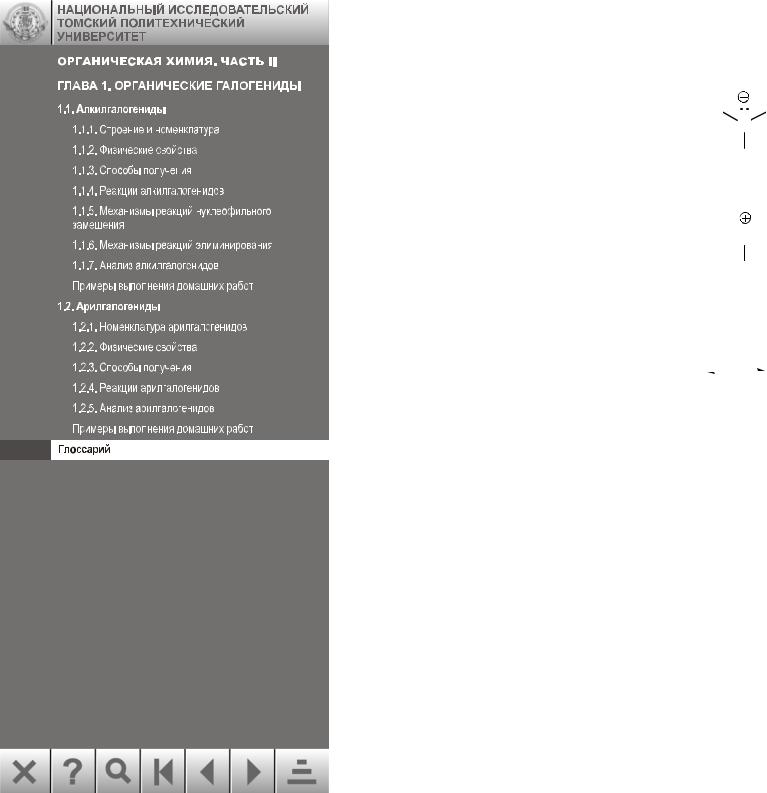
57.Карбокатион - положительно заряженная частица с тремя заместителями при центральном атоме углерода, имеющем одну вакантную несвязывающую орбиталь
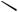 C
C
58. Кето-енольная таутомерия – превращение изомера, содержащего карбонильную группу (кето-форма) в изомер, содержащий ОН-группу при двойной углерод–углеродной связи (енольная форма).
|
H |
|
O |
|
|
|
|
|
|
|
|
OH |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
|
|
|
|
|
C |
|
C |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кето-форма |
|
енольная форма |
||||||||||||||||||
59.Кине-замещение – реакция замещения (для ароматических соединений), в которой входящая группа занимает положение, соседнее с положением, которое занимала уходящая группа.
60.Кинетический контроль состава продуктов - термин характеризующий условия (включая время реакции), которые приводят к продуктам реакции в соотношении, контролируемом относительными скоростями параллельных (прямых) реакций, ведущих
ких образованию.
61.СН-Кислота – соединение, которое может отдавать протон, связанный с атомом углерода, какому-либо подходящему основанию, образуя при этом карбанион. Наиболее известными СН-кислотами являются алкины с концевой тройной связью.
62.Кислота Льюиса – молекула, представляющая собой акцептор электронной пары, и поэтому способная реагировать с основанием Льюиса с образованием аддукта
путем обобществления электронной пары, представляемой основанием. Типичными кислотами Льюиса являются Н+, BF3 и AlCl3.

63.Кислотность соединения – для кислот Бренстеда означает тенденцию данного соединения выступать в роли донора протонов. Количественно выражается константой диссоциации данного соединения в воде или другой среде.
64.Кислотность среды – тенденция среды протонировать стандартные основания. Количественно выражается функцией кислотности.
65.π-Комплекс – неустойчивый аддукт, образованный какой-либо электронодефицитной частицей с π-связью как донором электронов. Эта частица может иметь целый или частичный положительный заряд.
66.σ-Комплекс – частица, содержащая σ-связь вместо исчезнувшей в результате присоединения электрофила π-связи. σ-Комплекс- это карбокатион, образованный путем присоединения катиона к π-связи.
67.Ковалентная связь – связь между двумя ядрами за счет обобщенной электронной пары между ними. Она может рассматриваться как результат электростатического притяжения двух атомов к этой электронной паре. Обычно
ковалентные связи бывают как σ- так и π-типа.
68. Константа кислотности Ка (константа диссоциации) – величина, характеризующая силу кислоты. Если кислота НА диссоциирует в воде следующим образом:
HA + H2O 
 H3O + A
H3O + A
то Ка определяется по уравнению:
Ka = |
[H3O][A ] |
|
[ HA] |
||
|
где НА – концентрация недиссоциированной кислоты.
69.Конфигурация – расположение атомов, характеризующее определенный стереоизомер.
70.Конформеры, конформации – различные пространственные формы одного и того же вещества, образующиеся за счет поворота групп атомов вокруг простых связей.

71. Конъюгация, сопряжение – в структурной формуле последовательность простых и кратных связей, содержащая минимум две кратные связи. Применяется также
кперекрыванию атомных р-орбиталей трех или более соседних атомов.
72.Кратная связь – притяжение атомов, являющееся результатом обобществления более чем одной пары электронов между двумя ядрами. При обобществлении двух пар
(одной σ и одной π) образуется двойная связь. В случае, если обобществлены три пары электронов (одной σ и две π), образуется тройная связь.
73.Крахмал – природный полисахарид, образующийся в процессе фотосинтеза. Он содержится в корнях, клубнях и семенах растений.
74.Крезолы – метилфенолы.
75.Крекинг – процесс термического разложения, протекающий при нагревании органических веществ без доступа воздуха и приводящий к образованию соединений с меньшей относительной молекулярной массой.
76.Ксилолы – диметилбензолы.
77.Кумол – изопропилбензол.
78.Мезомерный эффект (эффект сопряжения, резонансный эффект)— смещение электронной плотности в сопряженных системах с участием π-связей или неподеленных электронных пар.
79.Мета-положение – положение в бензольном кольце, удаленное от атома, служащего точкой отсчета, на один атом углерода. В монозамещенном бензоле имеются два мета-положения.
80.Металлоорганическое соединение – соединение, содержащее связь углерод– металл. Например: СH3MgBr (метилмагнийбромид), C4H9Li (бутиллитий).
81.Молекулярная орбиталь – орбиталь, образовавшаяся в результате перекрывания двух или более атомных орбиталей. Молекулярные орбитали могут быть трех типов: связывающие, несвязывающие и разрыхляющие. Молекулярная орбиталь, энергия которой выше энергии предшествующей атомной орбитали, называется разрыхляющей. Молекулярная орбиталь с энергией, равной энергии предшествующей атомной орбитали, является несвязывающей. Молекулы имеют одинаковое число молекулярных орбиталей.
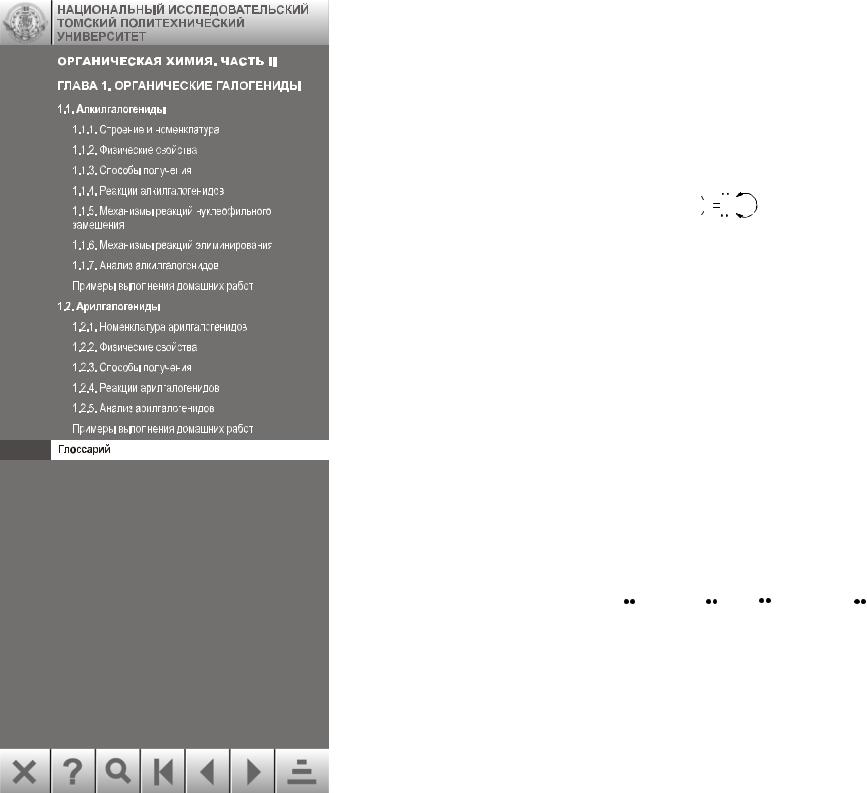
82.Мономолекулярная реакция – реакция, в которой только одна частица участвует
вобразовании и (или) разрыве связи в активированном комплексе.
83.Неподеленная пара электронов – пара валентных электронов, которая не участвует в образовании связи между двумя атомами. В формальдегиде две пары электронов кислорода, которые не участвуют в образовании связи с углеродом, являются неподеленными (несвязывающими)
84.Номенклатура – система названий, употребляющейся в какой-либо науке (от латинского – nomenklatura – перечень имен).
85.Нуклеофильное замещение в ароматическом ряду – замещение галогена, связанного с ароматическим кольцом, под действием нуклеофила. Существует два механизма нуклеофильного замещения: а) процесс присоединения–элиминирования (с
участием σ-комплекса) SNAr – для активированных (содержащих сильные электроноакцепторные группы) арилгалогенидов; б) процесс элиминирования–присоединения (с участием арина) – для неактивированных (содержащих электронодонорные группы) арилгалогенидов;
86.Нуклеофильное присоединение (AN) – реакция, начинающаяся с присоединения нуклеофила к карбонильной группе (С=О) или другой кратной связи.
87.Нуклеофил – любой атом или группа атомов, являющиеся донорами
электронов. Название нуклеофил происходит от латинских слов nucleus – ядро и phileo – любить. Нуклеофилами могут быть отрицательно заряженные ионы (Cl–, OH–, CH3–) и нейтральные частицы или молекулы, имеющие атом с неподеленной парой электронов
H2O |
CH3OH |
NH3 |
C2H5NH2 |
88.Олефин – старое название алкена. Этилен реагирует с хлором, образуя жидкий 1,2-дихлорэтан, вследствие чего этилен издавна называли маслообразующим газом (olefiant gas). Со временем название сократилось до олефина и стало обозначать весь класс соединений, содержащих двойную связь.
89.Омыление – щелочной гидролиз сложного эфира.

90.Органическая химия – наука, которая изучает состав, строение, свойства и способы получения органических веществ, а также закономерности реакций, протекающих с их участием.
91.Орто-положение – положение в бензольном кольце, соседнее с атомом, служащим точкой отсчета. В монозамещенном бензоле имеются два орто-положения.
92.Пара-положение – положение в бензольном кольце, отделенное от атома, служащим точкой отсчета двумя атомами углерода. В монозамещенном бензоле имеются одно пара-положение.
93.Первичный спирт – спирт, в молекуле которого углерод, несущий гидроксильную группу, связан только с одним органическим алкильным радикалом.
94.Переходное состояние – максимум на энергетическом профиле реакции:
95.Пероксид – соединение, содержащее связь –О-О-. Органические пероксиды неустойчивы и при нагревании могут взрываться. Они служат хорошими инициаторами радикалов благодаря легкости, с которой разрывается кислород-кислородная связь.
96.Пинакон – дитретичный двухатомный спирт, содержащий группы ОН у соседних атомов углерода.
97.Пиролиз – разложение органических соединений при высокой температуре.
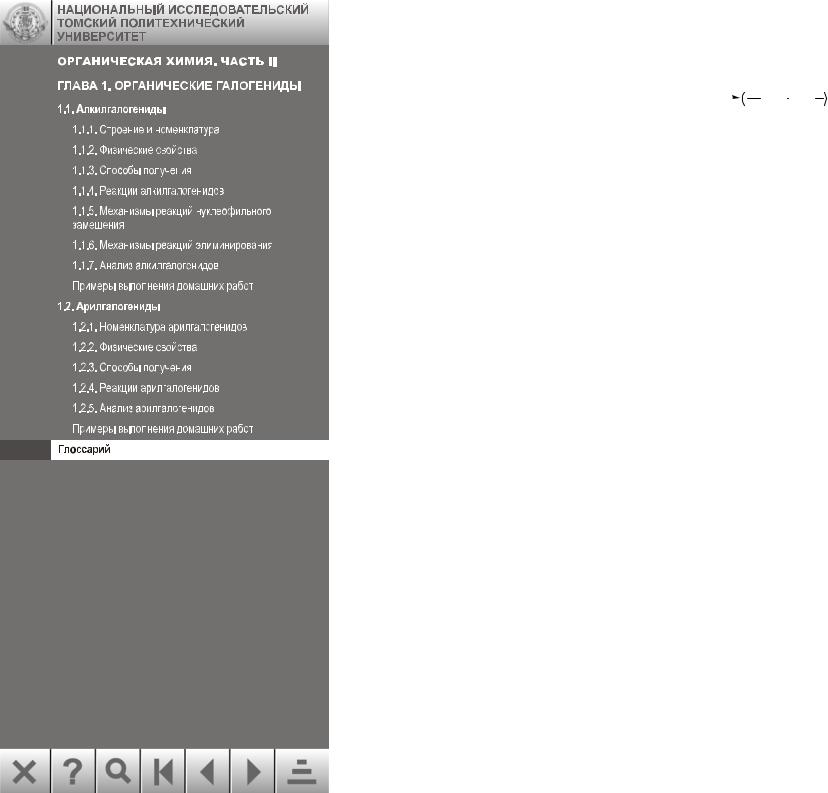
98. Полимеризация – присоединение друг к другу большого числа молекул одного вещества с образованием крупной молекулы, например полимеризация этилена:
n CH2=CH2 |
|
CH2 CH2 n |
|
этилен полиэтилен
где n – степень полимеризации или число соединившихся друг с другом молекул.
99.Правило Зайцева – элиминирование из субстрата, в котором уходящая группа отрывается в виде аниона; приводит к наиболее замещенному алкену. Эта закономерность была открыта в 1875 году выдающимся русским химиком, учеником Бутлерова Зайцевым Александром Михайловичем.
100.Правило Марковникова – правило, согласно которому при присоединении
несимметричного реагента (HCl, HBr, HOH) к несимметричному алкену (R–CH=C–R2) атом водорода реагента присоединяется к атому углерода при двойной связи, имеющему наибольшее количество атомов водорода. Правило было сформулировано в 1869 году учеником Бутлерова выдающимся русским химиком В.В. Марковниковым.
101.Правило Хюккеля – требования, предъявляемые к π-электронной системе для того, чтобы она была ароматичной. Правило Хюккеля утверждает, что частицы,
содержащие [4n + 2] π-электронов, вовлеченных в замкнутую цепь сопряжения, будут обладать повышенной термодинамической устойчивостью.
102.Проба Лукаса – тест для определения характера спирта – первичного, вторичного или третичного, основанный на превращения спирта в алкилхлорид. Эта проба показывает легкость образования карбокатиона из данного спирта.
103.Простой эфир – соединение, содержащее связь R–O–R.
104.Радикал – атом или группа атомов, имеющих неспаренный электрон. Простые радикалы не заряжены. Парамагнитные ионы обычно рассматривают как радикалы.
105.Реакционная способность – термин выражает кинетическое свойство. Соединение является более реакционноспособным, чем другое, если оно имеет большую константу скорости в определенной элементарной стадии реакции с тем же самым партером.

106.Реакция Канницаро – реакция диспропорционирования между двумя альдегидами, не содержащих водородных атомов при атоме углерода, соседнем с карбонильной группой. В результате образуются спирт и соль карбоновой кислоты. Катализируется основаниями.
107.Реакция конденсации – реакция с участием двух или нескольких реагентов, в которой образование основного продукта сопровождается образованием воды или других (аммиака, этанола, сероводорода) простых соединений.
108.Реакция замещения – элементарная или многостадийная реакция, в которой один атом или группа замещается другим атомом или группой.
109.Реакция элиминирования – реакция, обратная реакции присоединения.
110.АЕ–реакция – присоединение, начинающееся с реакции положительно заряженной частицы с π-связью.
111.SN1–реакция – мономолекулярное нуклеофильное замещение. Реакция, протекающая через алкильный карбокатион. Несогласованный двухстадийный процесс.
112.SN2–реакция – бимолекулярное нуклеофильное замещение. Согласованный
процесс.
113.Рацемизация – превращение энантиомера в рацемат (смесь равных количеств обоих энантиомеров).
114.Рацемическая модификация (рацемат) – совокупность равных количеств энантиомеров.
115.Реагент – органическое или неорганическое вещество, участвующее в реакции
ивоздействующее на субстрат.
116.Реакция этерификации – реакция карбоновой кислоты и спирта в присутствии каталитического количества сильной кислоты (H2SO4, H3PO4), в результате которой
образуются сложный эфир и вода.
117. Резонанс – изображение реальной молекулы с помощью гипотетических структур. Этот способ применяют в тех случаях, когда для адекватного описания данного соединения не может быть использовано единственное электронное распределение.

118.Ректификация (перегонка) – разделение сложных смесей на фракции или отдельные компоненты на основании разлиция в их температурах кипения.
119.Риформинг – переработка нефтепродуктов с целью получения ароматических углеводородов и водорода.
120.Семиполярная связь – взаимодействие между атомами, включающее как ковалентную связь, так и притяжение между противоположными зарядами. Можно представить, что она образована за счет того, что электронная пара (от незаряженного донора) переходит на вакантную орбиталь (незаряженного) акцептора.
121.Соль аммония – соль, катионным центром которой служит атом азота, связанный с четырьмя группами, включая протоны.
122.Соль диазония – соль с катионом типа
RN N
N
123.Соль Мейзенгеймера – устойчивый анионный σ-комплекс. Продукт присоединения аниона к π-системе бензола или его производных. Она не является ароматическим соединением, хотя ее отрицательный заряд сильно делокализован. Соль содержит активные электроноакцепторные группы при бензольном кольце.
H3CO OC2H5
O2N NO2
Комплекс (соль) Мейзенгеймера
K
NO2
124.Сопряженные двойные связи – расположение чередующихся простых и двойных связей. Простейшая молекула, содержащая две сопряженные двойные связи – это бутадиен-1,3.
125.Сопряженная система – расположение электронов, при котором потенциально подвижные электроны (как правило, неподеленные пары и электроны π-связей) разделены простой связью.
126.Сложный эфир – соединение, содержащее остаток спирта и остаток либо неорганической кислородсодержащей кислоты, либо карбоновой кислоты.
