
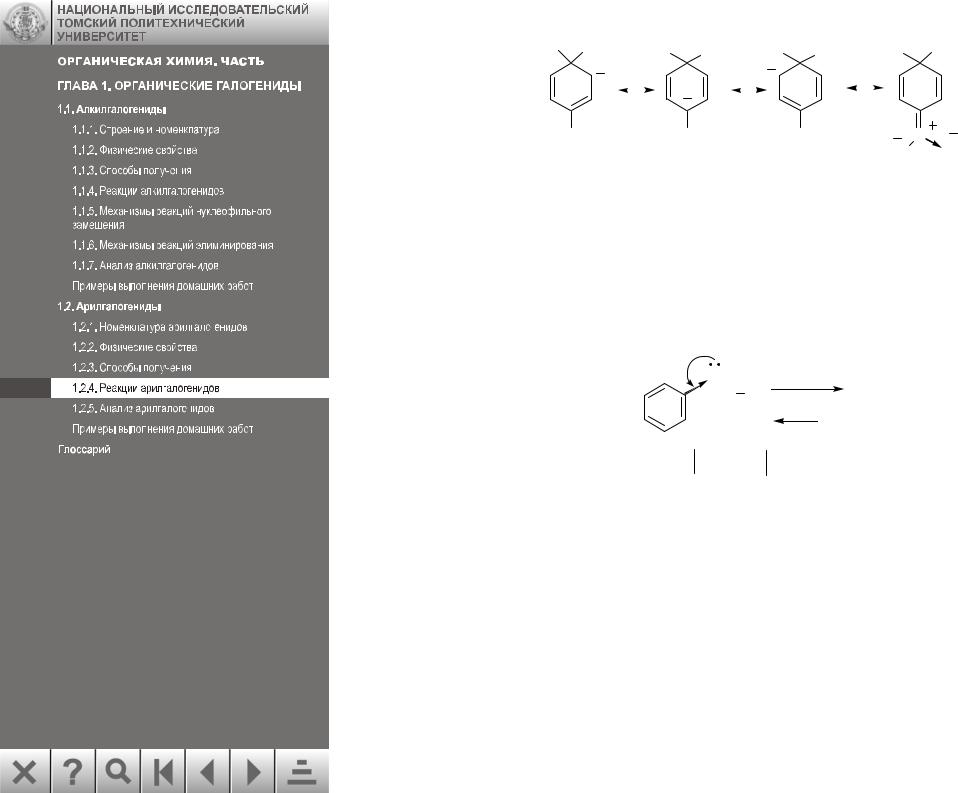
Механизм нуклеофильного замещения в активированных арилгалогенидах
Этот механизм, обозначаемый как SNAr, наиболее изучен. Доказано, что реакция идет в две стадии:
NO2 |
|
NO2 |
NO2 |
|
+ OH медленно |
быстро |
+ Cl |
Cl |
Cl |
OH |
OH |
|
(A) |
||
|
|
|
Вначале нуклеофил присоединяется к субстрату, образуя промежуточный продукт (А), от которого затем отрывается анион хлора. Обычно лимитирующей является первая стадия. Представленный механизм сходен с механизмом электрофильного ароматического замещения. Наиболее убедительным доказательством механизма SNAr служит выделение интермедиатов (В) в виде устойчивых солей. Эти соли называются солями Мейзенгеймера, они получены им еще в 1902 году:
|
OEt |
EtO |
OMe |
|
O2N |
NO2 |
|
||
O N |
NO |
2 |
||
|
|
2 |
|
+OMe
NO2 |
N |
O O
(B)
Строение некоторых интермедиатов такого типа было подтверждено данными ЯМРспектроскопии и рентгеноструктурного анализа.
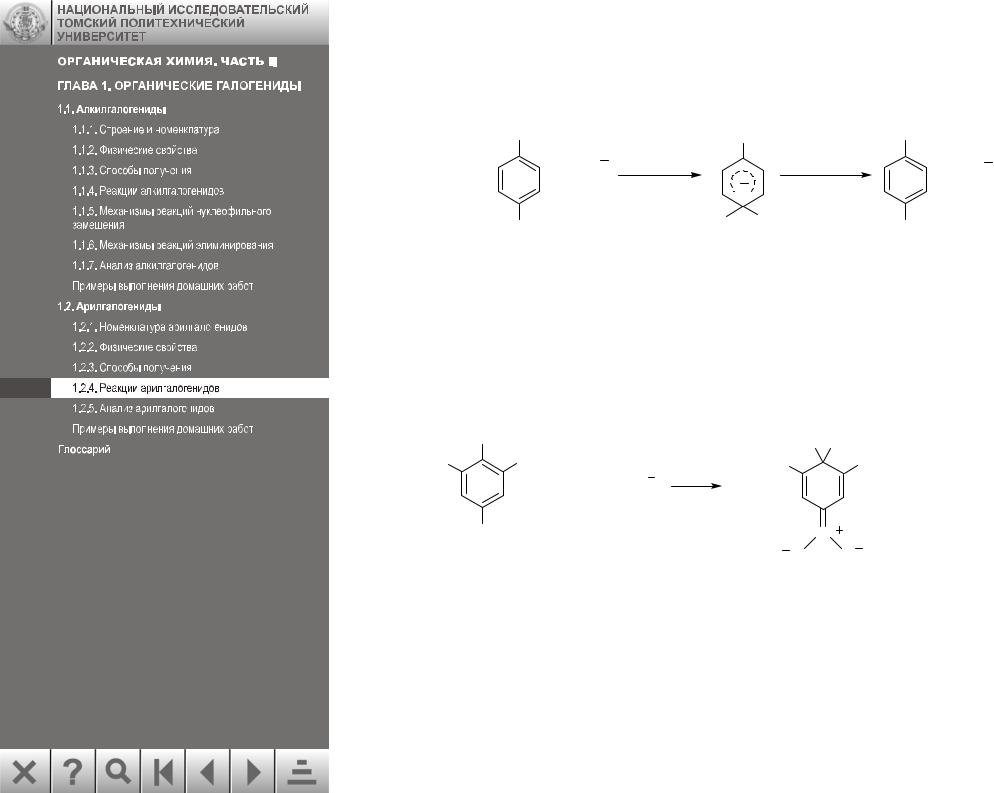
Образование анионных σ-комплексов (А) становится возможным при наличии электроноакцепторных заместителей, которые стабилизируют анион по механизму сопряжения. Строение комплекса (А) можно представить набором резонансных структур:
Cl OH |
Cl OH |
Cl OH |
Cl OH |
|
|
|
NO2 |
|
NO2 |
|
NO2 |
|
O |
N |
O |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Заместители в мета-положении к атому галогена не могут участвовать в стабилизации анионного σ-комплекса (А) и поэтому не влияют на реакционную способность арилгалогенидов.
1.2.4.3. Электрофильное замещение водорода в ароматическом кольце
Галогены необычно влияют на реакцию электрофильного замещения в ароматическом ряду: они оказывают дезактивирующее действие, оставаясь орто-, и пара- ориентантами. Дезактивация происходит в том случае, когда электроны оттягиваются с кольца, а орто- и пара-ориентация – когда электроны подаются на кольцо:
Cl
I
 M
M

 I >
I > 
 M
M
Атом хлора более электроотрицателен, чем атом углерода, он обладает отрицательным индуктивным эффектом (–I). Вместе с тем неподеленная пара электронов атома хлора перекрывается с электронным облаком бензольного кольца (+М) – положительный мезомерный эффект. Индуктивный эффект атома хлора сильнее, чем мезомерный, этим и объясняется дезактивирующее влияние галогена.
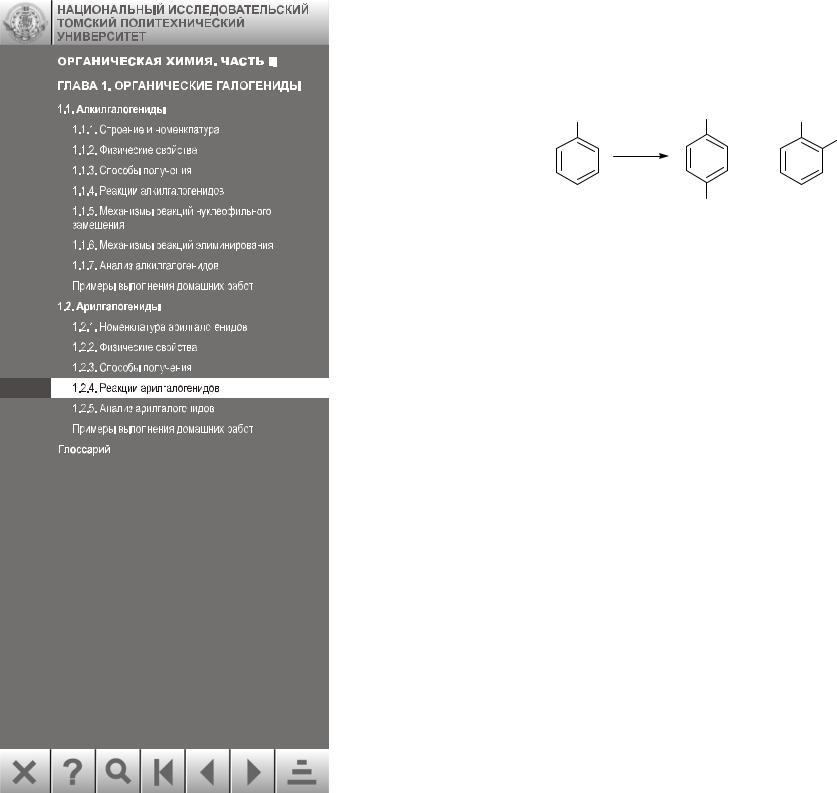
Для арилгалогенидов характерны типичные реакции электрофильного замещения: нитрование, сульфирование, галогенирование.
Cl |
|
Cl |
Cl |
|
HNO3 |
+ |
NO2 |
|
H2SO4 |
+ H2O |
|
|
|
|
|
|
|
NO2 |
|

1.2.5. Анализ арилгалогенидов
Ввиду неподвижности галогена в бензольном кольце арилгалогениды невозможно идентифицировать, используя спиртовый раствор AgNO3. Присутствие галогена в ароматических галогенидах можно обнаружить, используя пробу Бельштейна и сплавление с натрием (более подробно см. разд. 1.7.).
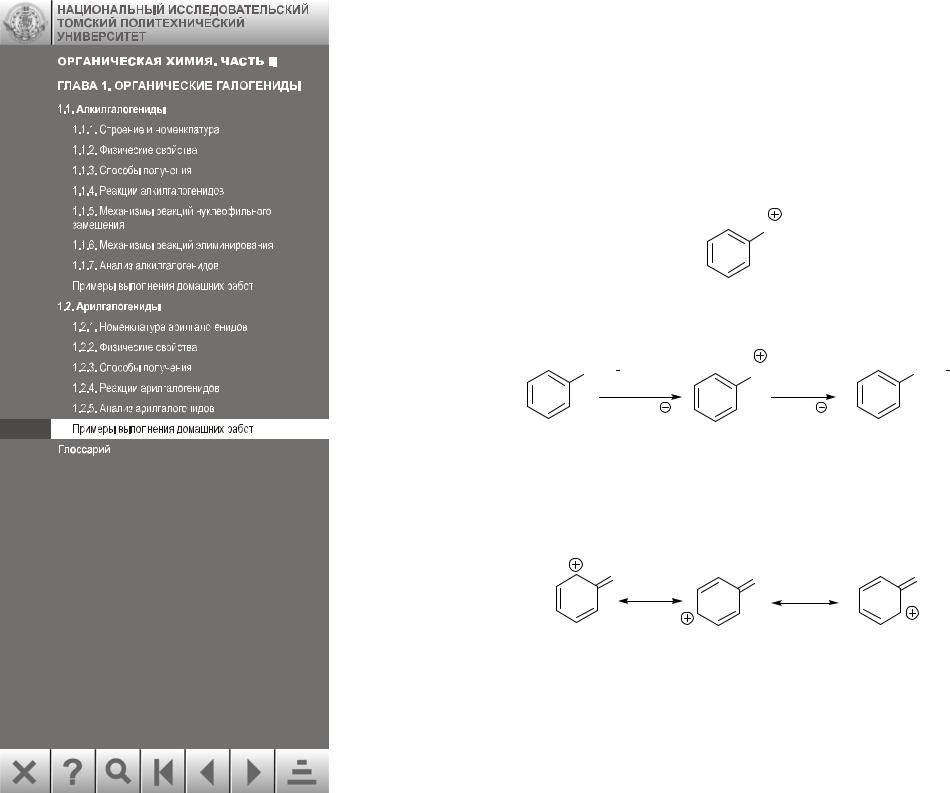
Примеры выполнения домашних заданий
Задача 1.
Объясните различную подвижность галогена в молекулах α–хлорбензила и п- хлортолуола. Напишите схему щелочного гидролиза этих соединений.
Решение.
Из двух органических галогенопроизводных наиболее подвижен галоген в молекуле α–хлорбензила:
 CH2
CH2
Реакция гидролиза этого вещества протекает по механизму SN1:
CH2 |
Cl |
CH |
2 |
CH2 OH |
|
медленно |
|
быстро |
|
|
- Cl |
|
|
OH |
Для замещения по этому механизму наиболее важным фактором является устойчивость карбокатиона, образующегося на первой лимитирующей стадии процесса. Устойчивость бензильного карбокатиона обусловлена делокализацией положительного заряда на метиленовой группе за счет сопряжения с бензольным кольцом. Это же можно изобразить с помощью резонансных структур.
CH2 |
CH |
2 |
CH2 |
|
|
|

В молекуле п-хлортолуола р-π сопряжение способствует тому, что связь хлор – углерод укорачивается и галоген становится малоподвижным. Его замещение протекает в очень жестких условиях (концентрированная щелочь, катализатор, давление, повышенная температура) через стадию образования дегидробензола по так называемому кинемеханизму.
CH3 |
|
CH3 H |
HO |
CH3 |
CH |
NaOH |
O |
|
3 |
||
|
2 |
|
|
|
|
-NaCl, H2O |
|
|
HO |
|
|
Cl |
|
|
|
|
|
Задача 2.
Осуществите следующие превращения. Назовите все продукты.
бензол |
CH2 |
|
CH2 |
A |
Br2 |
B |
KOH |
C |
Br2 |
D |
2KOH |
E |
||
|
||||||||||||||
|
||||||||||||||
|
|
|
|
hν |
|
|
спирт.р. |
|||||||
|
|
H+ |
спирт.р. |
|
||||||||||
Решение.
1 стадия. Происходит электрофильное замещение в ароматическом ядре и образуется этилбензол:
CH2=CH2 |
CH |
CH |
|
2 |
3 |
H+
2 стадия. Происходит радикальное замещение в радикале этилбензола, образуется 1-фенил-1-бромэтан:
CH2 CH3 Br2 |
CH CH |
|
|
|
3 |
|
|
Br |
|
Hν |
|
|
|
|
3 стадия. Под действием спиртового раствора щелочи происходит отщепление HBr, образуется стирол:
CH CH3 |
KOH |
CH CH2 |
|
Br |
|
|
|
|
|
|
|
спирт.р
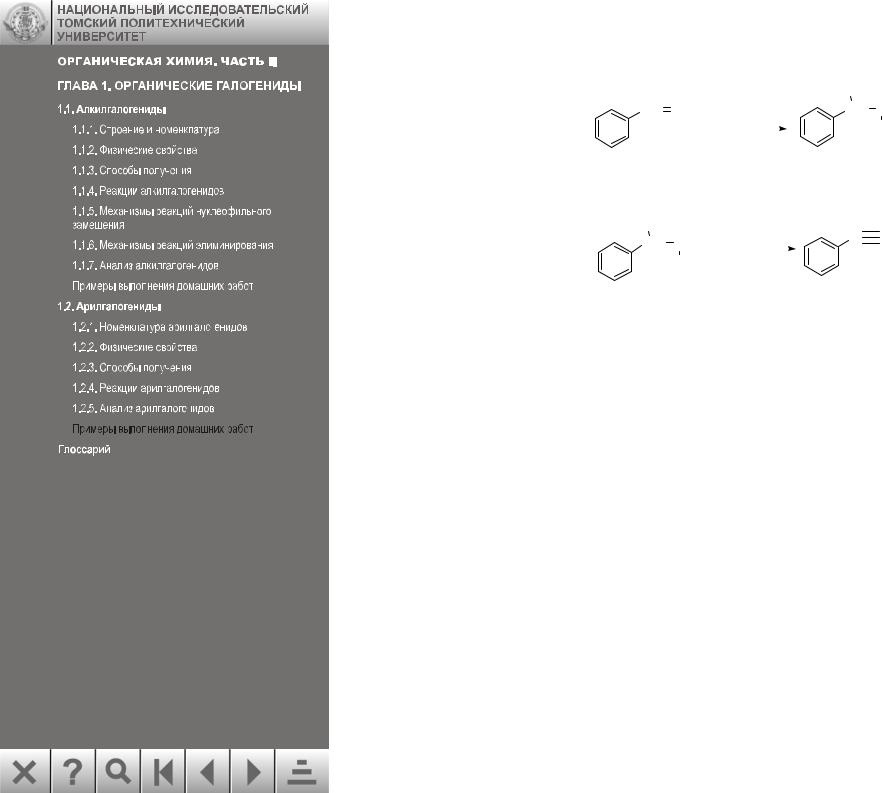
4 стадия. Происходит электрофильное присоединение брома по двойной связи, образуется 1,2-дибром-1-фенилэтан:
|
|
|
Br |
CH CH2 |
Br2 |
CH CH2 |
|
|
|
|
Br |
|
|
|
|
5 стадия. Под действием избытка спиртового раствора щелочи происходит отщепление 2 молекул HBr, образуется фенилацетилен:
|
|
Br |
2 KOH |
C CH |
|
|
CH CH2 |
||
|
|
|
|
|
|
|
Br |
спирт.р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

ГЛОССАРИЙ
1.Азосочетание – действие ароматических солей диазония на ароматическое кольцо, активируемое аминоили гидроксильной группой с образованием азосоединения.
2.Активированный комплекс – группировка атомов, присутствующая в переходном состоянии реакции;
3.Алканы – углеводороды, в которых все валентности атомов углерода, не затраченные на образование простых С–С связей, насыщены атомами водорода.
4.Алкены (олефины, этиленовые углеводороды) – непредельные углеводороды, молекулы которых содержат одну двойную связь С=С.
5.Алкины (ацетиленовые углеводороды) – непредельные углеводороды, молекулы которых содержат одну тройную углерод-углеродную связь.
6.Альдольная конденсация – превращение двух молекул альдегида, содержащих протон при атоме углерода, находящемся рядом с карбонильной группой, в β- гидроксиальдегид. Если продукт реакции имеет протон при атоме углерода, находящемся между гидроксильной и карбонильной группами, он неустойчив и дегидратируется при нагревании с образованием альдегида, содержащего двойную связь;
7.Аммонолиз – расщепление связи под действием аммиака.
8.Арин (дегидробензол) – ароматическое соединение с очень высокой реакционной способностью, которое содержит тройную связь. Примером простейшего арина является дегидробензол (бензин)
дегидробензол
9.Ароматическое соединение – циклическая молекула, устойчивость которой благодаря делокализации значительно больше, чем устойчивость гипотетической классической структуры (например, структуры Кекуле).
10.Асимметрический центр – атом углерода, связанный с четырьмя различными заместителями.

11.Ацетиленид – соль ацетилена (алкина) с концевой тройной связью.
12.Бензильное положение – атом углерода алкильной группы, который связывает эту группу с бензольным кльцом.
13.Бензоиновая конденсация – реакция между двумя молекулами ароматического альдегида, приводящего к образованию α-гидроксикетона, который называют бензоином. Катализатором реакции является цианид-ион.
Ar |
|
CH |
|
C |
|
Ar |
|||
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
Бензоин |
OH |
|
O |
|
||||||
14.Бимолекулярная реакция – реакция, в лимитирующей стадии которой участвуют две частицы.
15.Водородная связь – слабое взаимодействие между электротрицательным атомом
иатомом водорода, ковалентно связанным с другим электротрицательным атомом. Они могут быть меж- и внутримолекулярными. Обычно энергия этих связей 20-25 кДж/моль- 1. Наиболее часто встречающимися в органических соединениях электроотрицательными
элементами являются азот, кислород и фтор.
16.Вторичный спирт – спирт, в молекуле которого углерод, несущий гидроксильную группу, связан с двумя органическими алкильными радикалами.
17.Вицинальный – термин, показывающий, что заместители находятся у соседних атомов углерода, обозначается как виц-.
18.Галоформная реакция – превращение метилкетона в карбоновую кислоту и галоформ СНХ3, где Х= галоген, под действием смеси галогена и основания.
19.Геминальный - термин, показывающий, что заместители находятся у одного
атома углерода, обозначается как гем-. Например: метиленхлорид CH2Cl2 – это гем- дигалогенид.
20.Гетеролиз – расщепление связи, происходящее таким образом, что оба связывающих электрона остаются с одним из двух фрагментов, связь между которыми разрывается.
21.Гетероциклические соединения – содержат циклы, включающие наряду с атомами углерода один или несколько гетероатомов.

22.Гибридная орбиталь – атомная орбиталь, имеющая характеристики, отличные от характеристик s-, p-, d-или f-орбиталей. Все гибридные орбитали могут
рассматриваться как «смеси» двух или более типов простых негибридизованных орбиталей. Наиболее распространенным типом гибридных орбиталей служат sp-, sp2- sp3- орбитали. Гибридные орбитали свойственны только атомам в молекулах, а не отдельным атомам.
23.Гидратация – реакция присоединения воды по кратным связям.
24.Гидридный сдвиг – перенос водорода вместе со связанной с ним электронной парой (т. е. гидрид-иона Н–) от одного атома к другому. Этот перенос обычно превращает менее стабильный карбокатион в более стабильный.
25.Гидрирование – реакция присоединения водорода по кратным связям.
26.Гидрогалогенирование – присоединение галогеноводородов по кратным связям.
27.Гидролиз – расщепление связи под действием воды.
28.Гидроперекись – соединение, содержащее связь –О–О–; например гидроперекись этила СН3-СН2–О–О–Н.
29.Гидроборирование – присоединение диборана к π-связи с образованием органоборана (соединения, содержащего связь углерод – бор). Гидроборирование протекает как цис-присоединение против правила Марковникова.
30.Гидроформилирование – прямое присоединение синтез-газа (смесь СО и Н2) к алкенам при высоком давлении и повышенной температуре.
31.Гомолиз – расщепление связи, происходящее таким образом, что у каждого из молекулярных фрагментов, связь между которыми разрывается, остается один связывающий электрон.
32.Гомологи – члены одного гомологического ряда.
33.Гомологическая разность - метиленовая группа СН2.
34.Гомологический ряд – совокупность органических соединений, обладающих сходными строением и свойствами и отличающихся друг от друга по составу на одну или несколько метиленовых групп СН2.
