

1.2.2. Физические свойства
Физические свойства арилгалогенидов сходны с физическими свойствами алкилгалогенидов. Арилгалогениды не растворимы в воде и растворимы в органических растворителях.
Температуры плавления пара-изомеров значительно выше, чем орто- и мета- изомеров.
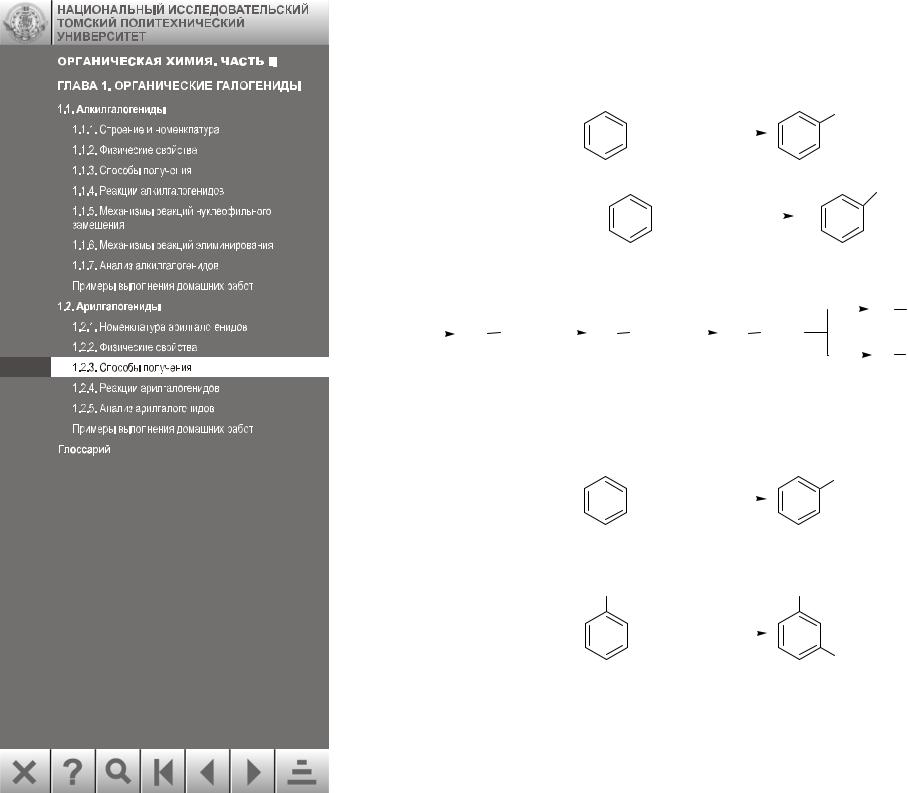
1.2.3.Способы получения
1.Галогенирование (см. разд. 1.2.3.1):
|
|
|
|
|
|
|
|
Fe |
Cl |
|
|
|||||
|
|
|
|
+ |
Cl2 |
|
+ |
|
HCl |
|||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
HNO3 |
|
|
|
I |
|
|||
|
|
|
|
|
|
+ I2 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
2. Из солей диазония (см. разд. 1.2.3.2): |
|
|
|
CuBr |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
Ar |
Br |
||||
ArH |
HNO3 |
|
Ar NO2 |
Fe |
Ar NH2 |
HNO2 Ar N2+X- |
|
|
|
|||||||
|
|
|
|
|||||||||||||
|
CuCl |
|
+ N |
|||||||||||||
|
|
|
||||||||||||||
H2SO4 |
Ar |
|||||||||||||||
|
|
HCl |
|
|
соль диа- |
Cl |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
зония
1.2.3.1.Реакции галогенирования ароматических соединений
Вприсутствии катализаторов или растворителей, способных поляризовать молекулу галогена, происходит замещение водорода в бензольном кольце на хлор или бром:
|
|
FeBr3 |
Br |
|
|
+ |
Br2 |
+ |
HBr |
||
|
|||||
бензол |
|
|
бромбензол |
|
|
NO2 |
|
|
NO2 |
|
|
+ |
Cl2 |
FeCl3 |
+ |
HCl |
|
|
Cl
нитробензол м-хлорнитробензол
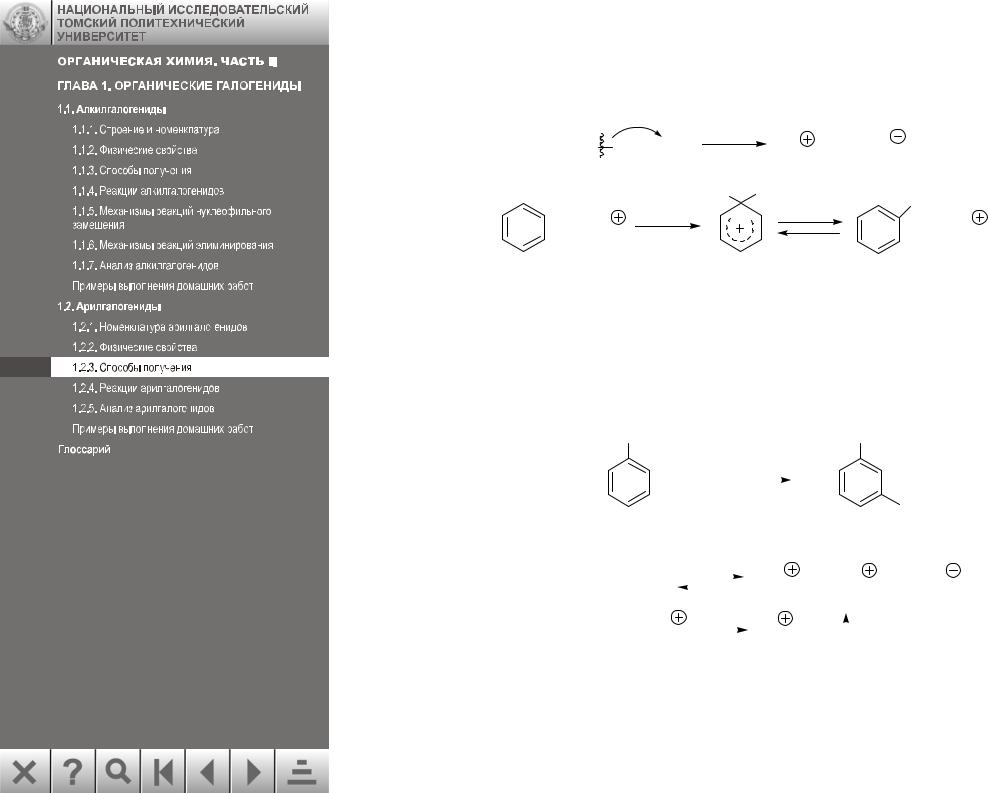
В качестве катализаторов используют кислоты Льюиса FeCl3, AlCl3 или железные опилки, которые в условиях реакции превращаются в FeCl3 или FeBr3. Кислоты Льюиса, взаимодействуя с молекулой галогена, вызывают ее поляризацию, генерируя электрофил:
Cl Cl + FeCl3 |
Cl |
+ FeCl4 |
Галогенирование в кольцо протекает как реакция электрофильного замещения:
H |
Cl |
Cl |
|
|
|
+ Cl |
|
+ H |
Из всех галогенов иод обладает самой низкой электрофильностью. Для его активации используют окислители (HNO3, HIO3, H2O2 и др.) и соли серебра. Классическим примером введения иода в ароматические соединения с использованием окислителя является система I2–HNO3–H2SO4 в уксусной кислоте (метод Тронова–Новикова). Этот метод был открыт в 1953-м году на кафедре органической химии Томского политехнического института Б. В. Троновым и А. Н. Новиковым и распространен на широкий круг ароматических субстратов:
|
NO2 |
|
NO2 |
|
2 |
+ I2 |
HNO3 |
2 |
|
H2SO4 |
||||
|
|
I |
||
|
|
|
Предполагают, что электрофил образуется по схеме:
2 H2SO4 + |
HNO3 |
|
|
|
|
|
NO2 |
+ H3O + 2 HSO4 |
||
|
|
|
||||||||
|
|
|
|
|
||||||
I2 |
+ 2 NO2 |
|
|
|
2 I |
+ 2NO2 |
|
|
||
|
|
|
|
|
||||||
|
|
|
||||||||
|
|
|
|
|
||||||
1.2.3.2. Получение арилгалогенидов из солей диазония
Это очень важная реакция синтеза ароматических соединений по следующим причинам. Прежде всего, через соли диазония можно получить фтор- и иодарены, которые лишь в редких случаях можно получить прямым галогенированием.
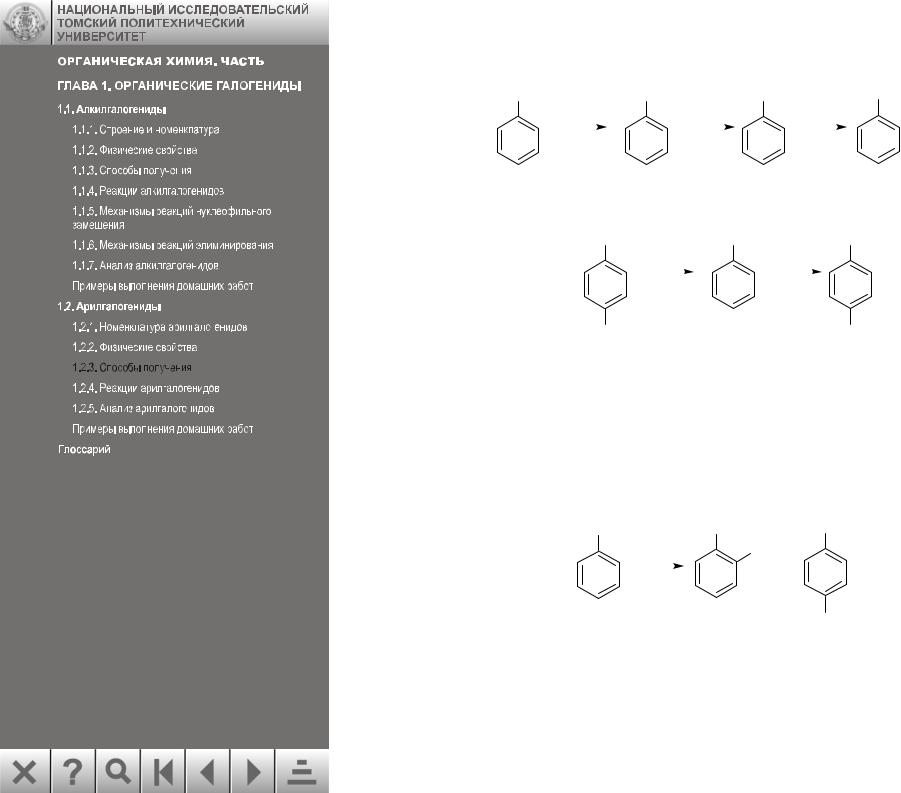
Например:
|
|
|
|
|
|
NH2 |
|
N2+Cl- |
|
N2+BF4- |
|
|
F |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
NaNO2, |
|
|
|
HBF4 |
|
|
|
toC |
|
+ N2 |
+ BF3 |
|||
|
|
|
|
|
|
|
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
фенилдиазо- |
|
|
|
|
|
|
фторбензол |
|
|||||
|
|
|
|
|
|
|
|
нийхлорид |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
NH |
2 |
|
|
|
N |
+HSO - |
|
|
I |
|
|||
|
|
|
|
|
|
|
|
|
NaNO2, |
2 |
4 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
KI |
|
|
+ N2 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
п-метиланилин |
|
|
|
|
|
п-иодтолуол |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Иногда очень трудно разделить смесь орто- и пара-изомеров, образующихся при галогенировании. Примером может служить бромирование толуола: о- и п-бромтолуолы разделить трудно из-за близости температур кипения, а вот о- и п-нитротолуолы можно разделить фракционной перегонкой. Поэтому о- и п-бромтолуолы можно получить из соответствующих нитропроизводных через соли диазония:
CH3 |
CH3 |
CH3 |
||
|
HNO3 |
NO2 |
+ H2O |
|
|
|
|
+ |
|
|
H2SO4 |
|||
|
|
|
||
|
|
|
|
NO2 |

Далее изомеры разделяют и параллельно восстанавливают, диазотируют и превращают в галогениды:
|
|
CH3 |
|
|
CH3 |
|
|
CH3 |
+Cl- |
|||||
|
|
NO2 |
Fe |
|
NH |
NaNO , |
|
N |
||||||
|
|
|
2 |
2 |
|
CuBr |
||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
HCl |
|
|
|
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|
|
CH3 |
|||
|
|
|
|
|
|
Fe |
|
|
|
NaNO2, |
|
|
|
|
|
|
|
|
|
|
HCl |
|
|
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
NO2 |
|
|
|
NH |
2 |
|
|
N +Cl- |
||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3
Br
+ N2
о-бромтолуол
CH3
CuBr
+ N2
Br
п-бромтолуол
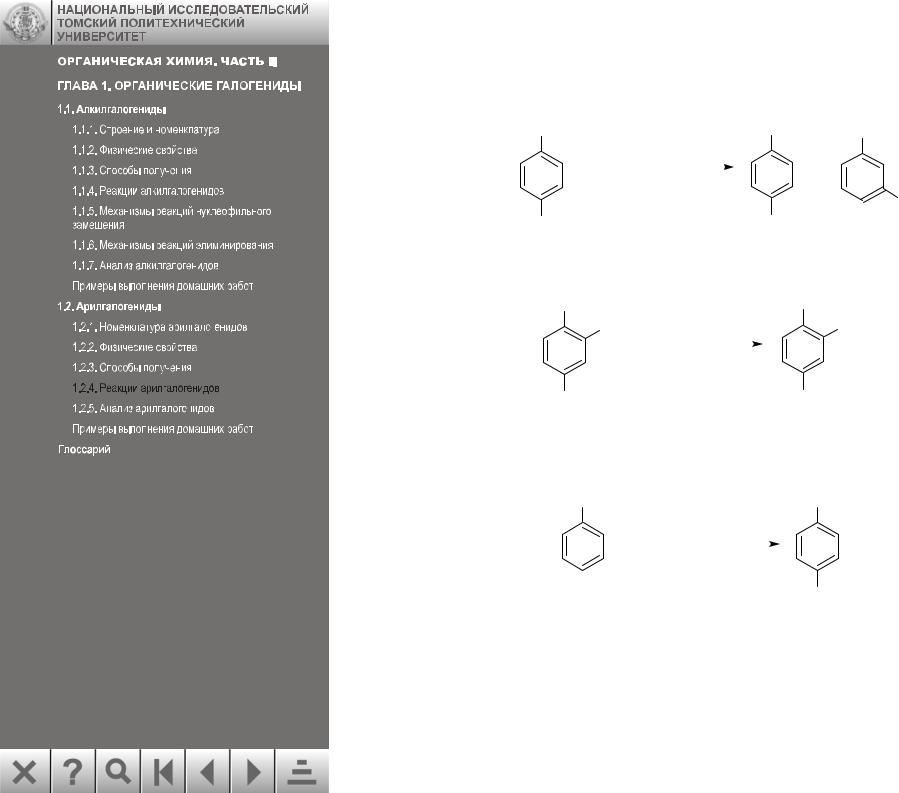
1.2.4.Реакции арилгалогенидов
1.Нуклеофильное замещение в неактивированных арилгалогенидах (cм. разд.
1.2.4.1):
CH3 |
340 oC |
|
CH3 |
CH3 |
|
+ NaOH |
|
+ |
+ NaCl |
||
|
p=300 атм |
||||
15-20 % |
|
OH |
|||
|
|
OH |
|||
Cl |
|
|
|
||
2. Нуклеофильное замещение в активированных арилгалогенидах (см. разд. 1.2.4.2):
|
|
Cl |
|
|
NH2 |
|
|
NO2 |
+ 2 NH3 |
|
NO2 |
|
|
|
|
+ NH4Cl |
|
|
|
|
|
||
|
|
NO2 |
|
|
NO2 |
|
|
|
|
||
|
|
|
2,4-динитрохлорбензол 2,4-динитроанилин
3. Электрофильное замещение водорода в ароматическом кольце (см. разд. 1.2.4.3):
Br |
|
Br |
+ H2SO4 |
|
+ H2O |
|
||
|
|
SO3H |
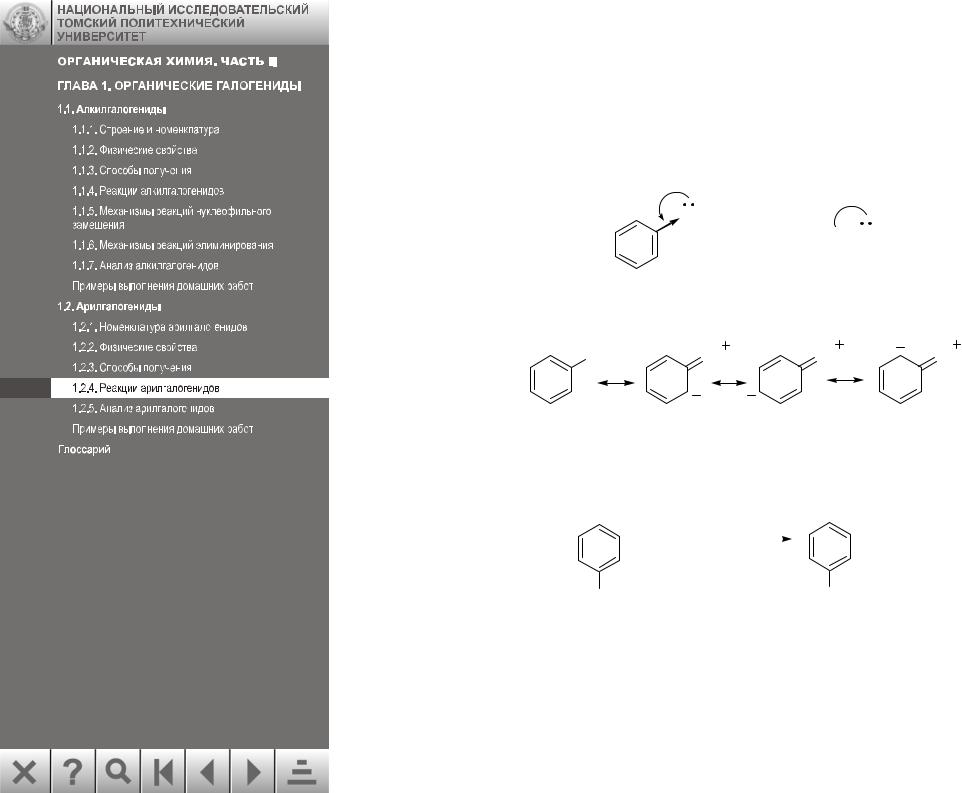
1.2.4.1. Нуклеофильное замещение в неактивированных арилгалогенидах. Механизм реакции
Арилгалогениды, в отличие от алкилгалогенидов, вступают в реакции нуклеофильного замещения с большим трудом. Низкая подвижность галогена в арил- и винилгалогенидах объясняется эффектом сопряжения между кольцом и галогеном, вследствие которого связь углерод-галоген укорачивается и становится более прочной:
Cl
H2C  CH
CH Cl
Cl
Эффект сопряжения можно представить набором резонансных структур:
Cl |
Cl |
Cl |
Cl |
По этой причине замещение галогена проходит в очень жестких условиях.
В промышленности фенол получают из хлорбензола под действием водных растворов щелочей при высокой температуре и давлении:
+ NaOH |
400 oC |
|
+ NaCl |
|
p=300 атм |
||||
(водн.) |
|
|||
|
|
|
||
Cl |
|
|
OH |
|
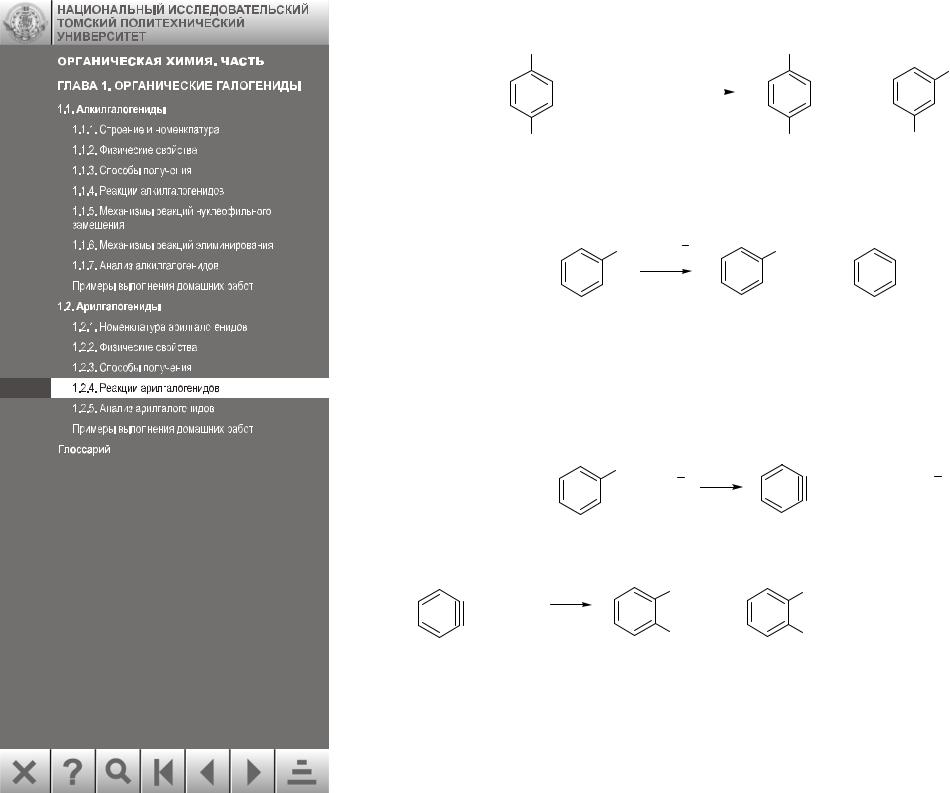
Механизм образования дегидробензола (ариновый механизм)
Известно, что замещение галогена в арилгалогенидах, не содержащих активирующих групп, проходит в довольно жестких условиях. Оно сопровождается тем, что входящая группа не всегда занимает положение, освобождаемое уходящей группой. Так, из п-броманизола образуются в равных количествах два изомерных продукта:
|
|
|
Br |
|
NH2 |
NH2 |
|
|
|
|
|
KNH2, NH3 |
(жидк.) |
+ |
|
|
|
|
|
||||
|
|
|
|
|
|||
|
|
|
|
|
|
OCH3 |
|
|
|
|
OCH |
|
OCH |
||
3 |
|
|
3 |
|
|||
|
|
|
п-броманизол |
|
п-аминоанизол |
м-аминоанизол |
|
Другим примером может служить реакция 1-14С-хлорбензола с амидом калия:
14 Cl NH2 |
14 NH2 |
14 |
|
|
+ |
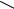 NH2
NH2
Продукт состоит из почти равных количеств анилина, меченного по положениям 1
и 2.
Реакции, сопровождающиеся перемещением группы, входящей в кольцо вместо галогена, получили название кине-замещения.
Приведенные факты можно объяснить механизмом, включающим элиминирование и последующее присоединение:
14 Cl |
14 + NH3 + Cl |
+ NH2 |
арин (дегидробензол)
14 |
14 NH2 |
14 H |
+ NH3 |
+ |
|
|
H |
NH2 |
арин
При действии сильного основания из α-положения бензольного кольца отщепляется активный водород в виде протона, из образовавшегося аниона вытесняется анион хло-
ра и образуется очень активная электронейтральная частица – дегидробензол или арин. Нуклеофильный реагент атакует симметричный арин и присоединяется к любому из двух связанных тройной связью атомов углерода с равной вероятностью.
Существуют и другие доказательства в пользу аринового механизма:
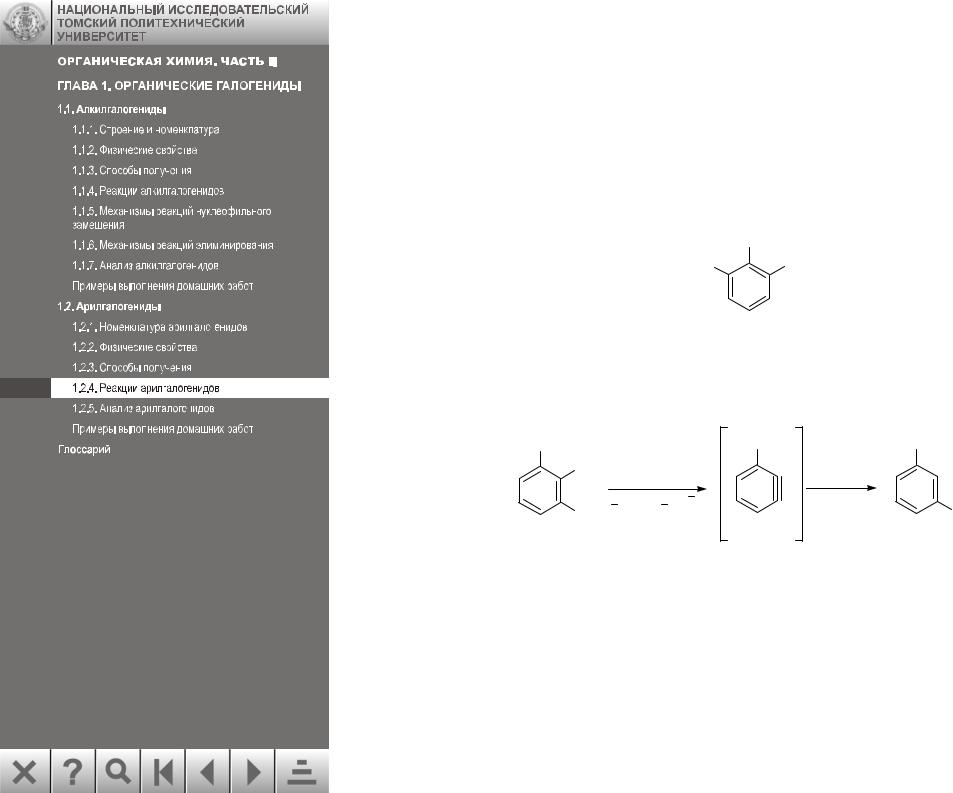
1. Арилгалогениды, имеющие два орто-заместителя, такие, например, как 2,6- диметилбромбензол, не вступают в реакции нуклеофильного замещения из-за невозможности образования дегидробензола. В этом соединении отсутствует водород в орто- положении, который должен отщепляться, и дегидробензол не образуется:
Br
H3C CH3
2. В некоторых случаях ароматическое нуклеофильное замещение происходит полностью по другому положению. Например, из о-броманизола при действии амида натрия образуется исключительно м-аминоанизол:
OCH |
|
OCH3 |
OCH3 |
3 |
|
|
|
Br |
NH |
2 |
NH3 |
|
|||
|
|
|
|
H |
NH3, |
Br |
NH2 |
|
|
||
|
|
(1) |
|
В этой реакции не образуется смеси изомеров, т. к. в несимметричном интермедиате (1) метоксигруппа направляет нуклеофил в мета-положение.
1.2.4.2. Нуклеофильное замещение в активированных арилгалогенидах
Если арилгалогениды содержат сильные электроноакцепторные заместители такие, как NO2, или CN в орто- или пара-положениях по отношению к галогену, то реакция нуклеофильного замещения осуществляется легко:
NO2 |
|
|
NO2 |
|
+ NaOH |
160 oC |
|
|
|
|
|
|
(15 %) |
|
|
Cl |
|
|
OH |
п-хлорнитробензол п-нитрофенол
Примечательно, что галоген, расположенный в мета-положении по отношению к нитрогруппе, не вступает в реакцию. Это позволяет проводить селективное замещение одного атома галогена:
Cl |
|
NH2 |
Cl |
|
Cl |
+ 2 NH3 |
|
+ NH4Cl |
|
||
NO2 |
|
NO2 |
3,4-дихлорнитробензол 4-нитро-2-хлоранилин
