
что соответствует приведенному выше механизму гидролиза. В лимитирующей стадии участвует только трет-бутилбромид.
Вторым доказательством рассматриваемого механизма являются перегруппировки карбокатионов, образующихся на первой стадии.
Так, в реакции втор-изопентилбромида с водным раствором щелочи образуется смесь двух изомерных спиртов с преобладанием третичного спирта, который получается в результате перегруппировки втор-изопентилкарбокатиона в более стабильный трет- пентилкарбокатион.
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
перегруппировка |
H3C |
|
|
|
|
CH3 |
|||||||||||||||
H3C |
|
|
|
CH |
|
|
CH |
|
CH3 |
|
|
|
|
|
H3C |
|
C |
|
CH |
|
|
CH3 |
|
|
|
|
|
|
C |
|
|
|
CH2 CH3 |
||||||||||||
|
|
|
|
|
|
|
- Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
H |
|
|
|
|
H3C |
|
|
|
|
CH3 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
C |
|
C |
|
CH3 |
|
|
|
|
C |
|
CH2 CH3 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
OH |
|
|
|
|
|
|
|
|
OH |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вторичный изо- |
|
|
третичный пентиловый спирт |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пентиловый спирт |
|
|
|
(главный продукт) |
|||||||||||||||||||||||||||
Этот вид перегруппировки, включающий перемещение гидрид-иона называется
гидридным сдвигом.
В реакциях, протекающих по SN2 механизму, перегруппировки невозможны, т. к. галоген не уходит от атома углерода до тех пор, пока к нему не присоединится нуклеофил, и карбокатион не образуется.
Реакционная способность алкилгалогенидов в SN1–реакции
Стадией, определяющей скорость реакции при SN1–замещении, является стадия образования карбокатиона. Поэтому можно ожидать, что реакционная способность алкил-
галогенидов зависит от устойчивости образующегося карбокатиона.

Действительно, реакционная способность алкилгалогенидов уменьшается в таком же порядке, как и устойчивость карбокатионов:
Аллил, бензил > третичный > вторичный > первичный > СН3Х
Таким образом, в SN1–реакциях предпочтительно участвуют субстраты, образующие стабильные промежуточные частицы. Это аллил-, бензил- и третичные галогениды. Менее благоприятна SN1–реакция для вторичных галогенидов, и совсем неблагоприятна для первичных алкилгалогенидов.
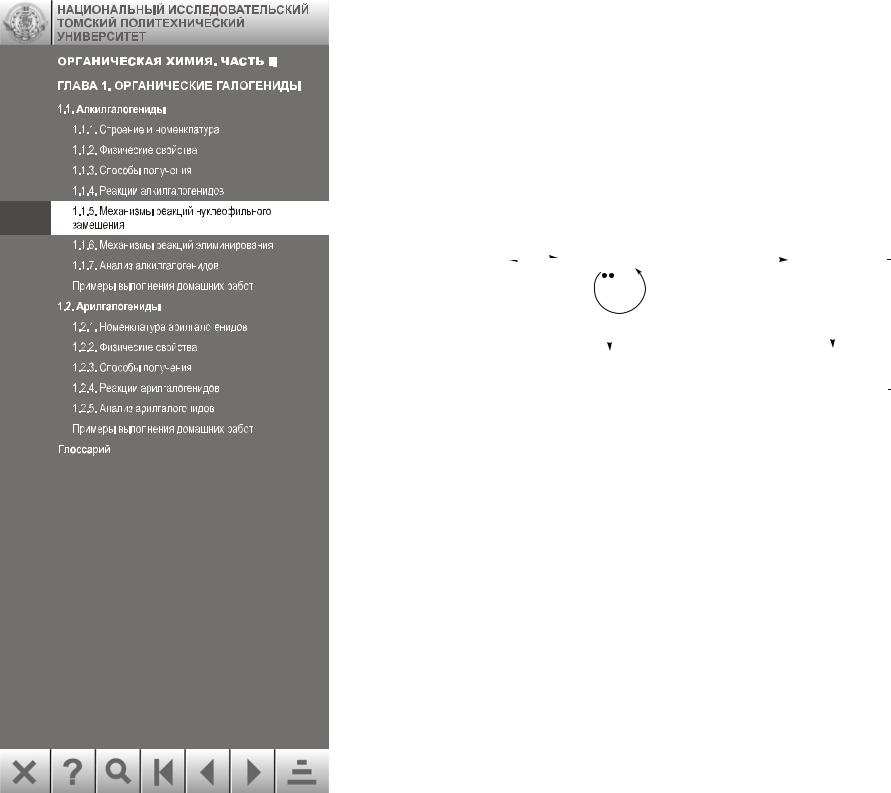
1.1.6. Механизмы реакций элиминирования
Реакции элиминирования (отщепления галогеноводородов от алкилгалогенидов) конкурируют с реакциями замещения. Обе реакции происходят при действии нуклеофильного реагента: атака по атому углерода приводит к замещению, а атака по атому водорода – к отщеплению:
X
S  C C H
C C H
Nu E
E
Для того чтобы провести реакцию элиминирования необходимо использовать малополярный растворитель и сильное основание, способное отщеплять протон.
Для реакций замещения используют водный раствор щелочи, а для элиминирования – концентрированный спиртовый раствор KOH или NaNH2 в аммиаке.
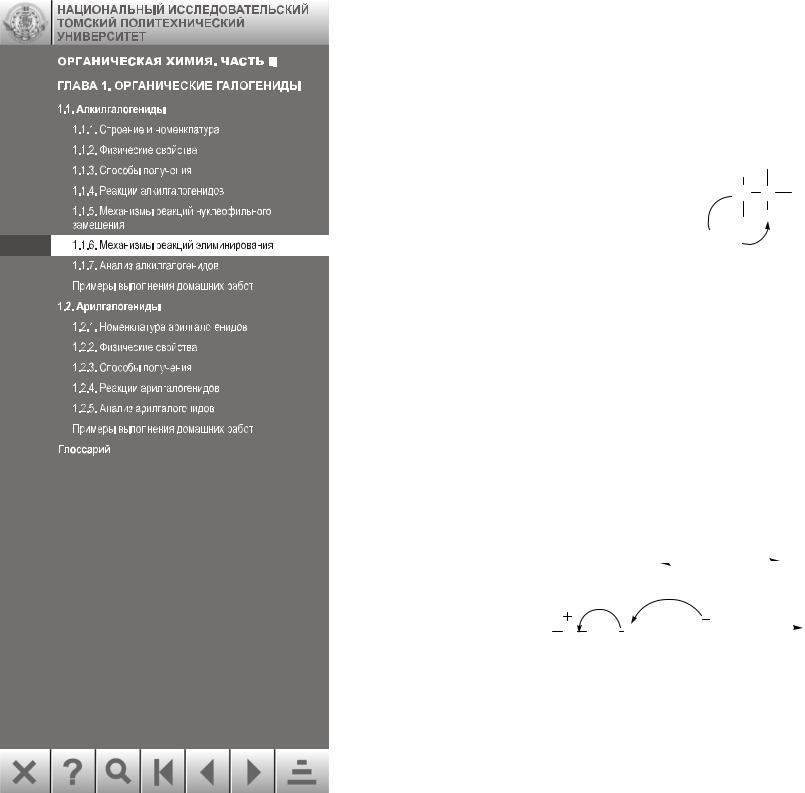
Существует два основных механизма реакций элиминирования Е1 и Е2.
1.1.6.1. Механизм реакции Е1 Е1-механизм – это мономолекулярное элиминирование, т. е. в стадии, опреде-
ляющей скорость реакции, участвует одна молекула. Реакции Е1 характерны для третичных и вторичных алкилгалогенидов. Механизмы Е1 и SN1 имеют одну и ту же лимитирующую стадию – образование карбокатиона:
|
|
|
H |
|
медленно |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
H3C |
|
C |
|
CH3 |
|
|
|
|
H3C |
|
C |
|
|
CH3 |
+ Br |
||||||||||
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
||||||||||
|
|
|
Br |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H C |
C CH H |
+ OH |
быстро |
H3C |
|
C |
|
CH2 + HOH |
|||||||||||||||||
|
|
|
|||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
3 |
H |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Если имеются несколько доступных элиминированию β-водородов, то отщепляется тот, в результате отщепления которого образуется более стабильный (более замещенный при двойной связи) олефин, как правило, в виде транс-изомера. Таким образом, реакции
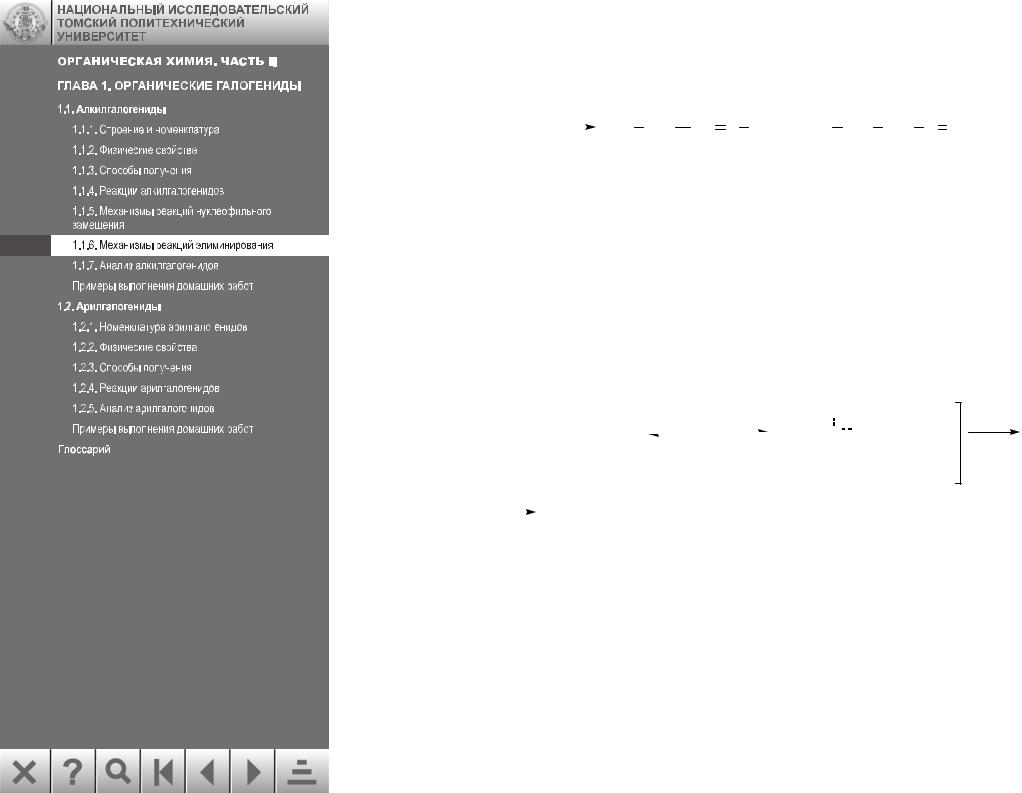
Е1 обычно протекают по правилу Зайцева, т. е. β-протон отрывается от наименее замещенного атома углерода:
|
|
|
|
|
β |
H β |
|
E1 |
H C H C HC C CH |
|
|
|
|
|
|||||||
H C |
|
H |
C |
|
H C |
|
C |
|
CH |
|
|
>> H C H C H C C CH |
|
||||||||
|
|
|
|
|
|
|
|||||||||||||||
3 |
2 |
2 |
|
|
|
|
|
3 - HBr |
3 |
2 |
H |
3 |
3 |
2 |
2 |
H |
2 |
||||
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|||||||
2-бромпентан |
|
|
|
транс-2-пентен |
|
|
|
1-пентен |
|
||||||||||||
(основной продукт)
Скорость реакции Е1 зависит только от концентрации алкилгалогенида:
VE1 = k[AlkBr]
1.1.6.2.Механизм реакции Е2
Вреакции, протекающей по механизму Е2 (бимолекулярное элиминирование) участвуют две молекулы. Механизм реакции Е2 можно представить следующим обра-
зом: основание отрывает протон от β-угле-родного атома одновременно с отщеплением галогенид-аниона и образованием двойной связи:
|
|
|
H |
|
|
|
|
|
|
|
|
медленно |
|
|
|
|
|
δ−I |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
H3C |
|
C |
|
|
CH3 |
+ OCH |
|
|
|
|
|
|
|
|
|
|
|
H |
C |
|
C |
|
CH |
|
|
|
|
|
|
H |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
3 |
|
|
H |
2 |
|
|
|
− |
|
|
||||||||||||||||
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
δ OCH3 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
CH3OH |
|
|
|
|
H3C |
|
C |
|
CH2 + I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Изучение кинетики реакции Е2 показывает, что скорость реакции зависит как от концентрации алкилгалогенида, так и от концентрации основания:
VE2 = k[AlkI][CH3O− ]
Реакция Е2 конкурирует с реакцией SN2. Для осуществления реакции Е2 требуются более высокие температуры и более сильные основания.
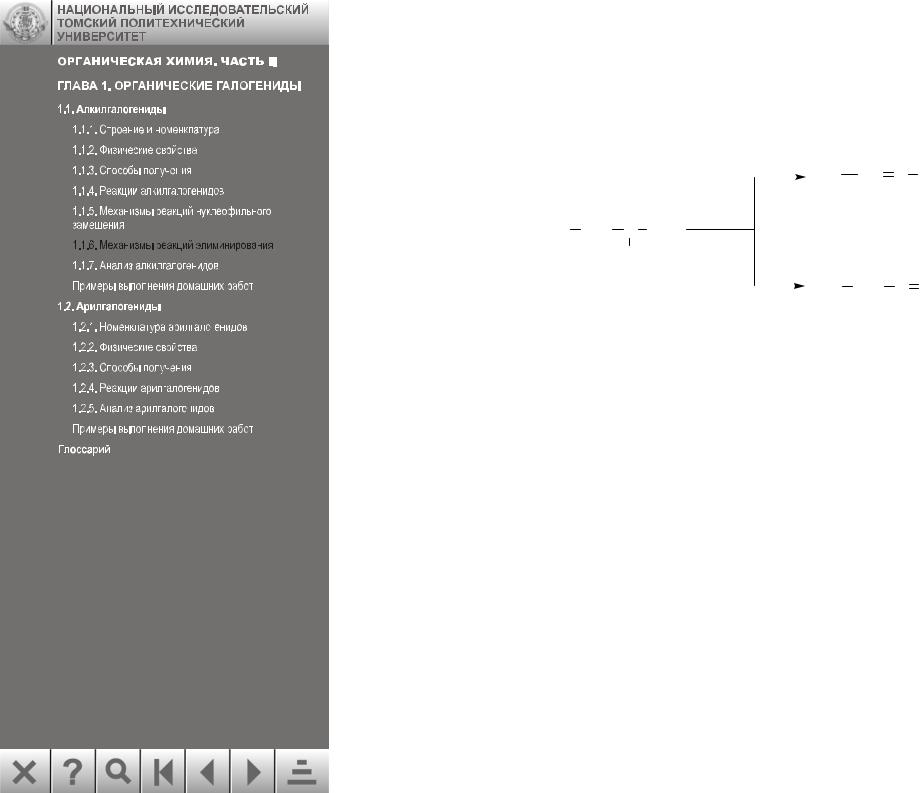
В реакциях по механизму Е2 участвуют все типы алкилгалогенидов, но наиболее характерны они для вторичных и третичных. Для первичных алкилгалогенидов с бóльшим преобладанием происходит SN2-реакция.
Как и в реакциях, протекающих по механизму Е1, отщепление галогеноводородов от несимметричных алкилгалогенидов подчиняется правилу Зайцева.
|
|
|
|
|
|
H3C HC C CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
β H β |
E1 |
|
|
2-бутен (81 %) |
|
|
H3C H2C C CH3 |
- HBr |
|
|
|
|
|
|
|
|
||
|
|
Br |
|
|
|
H3C H2C C CH2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
1-бутен (19 %) |
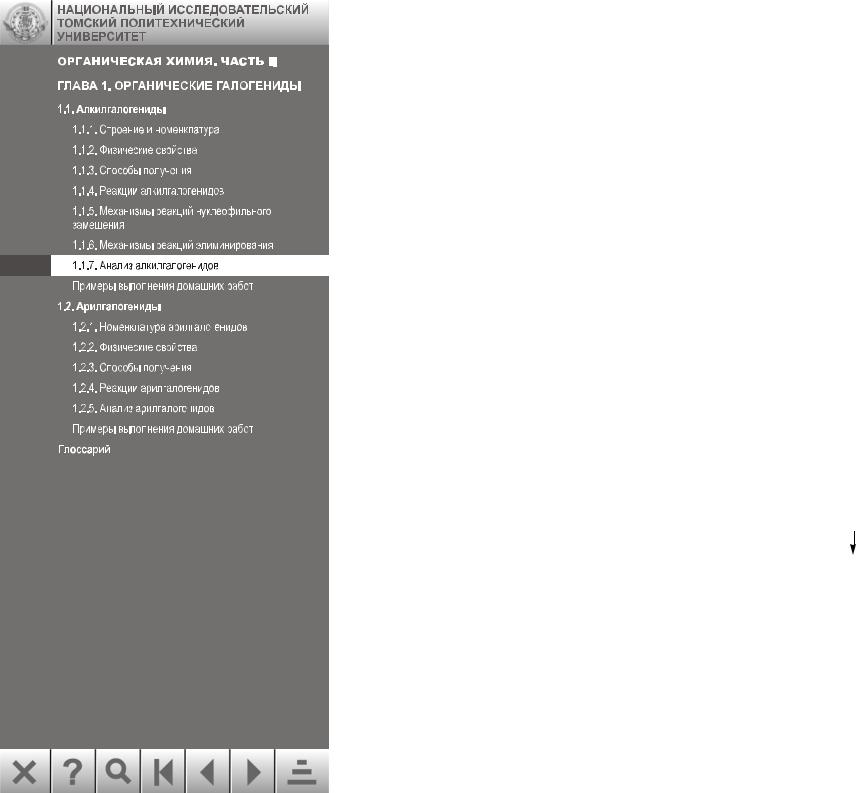
1.1.7. Анализ алкилгалогенидов
Очень чувствительной пробой на галогены является проба Бельштейна. Этот способ качественного обнаружения галогенов в органическом соединении был предложен русским академиком Ф. Ф. Бельштейном в 1872 году. Медную проволоку, на конце которой сделана небольшая петля, прокаливают в пламени горелки до прекращения окрашивания пламени и остужают. Затем в остывшую петлю помещают каплю или кристалл испытуемого вещества и снова вносят петлю в наиболее горячую часть бесцветного пламени. Появление ярко-зеленой окраски пламени свидетельствует о наличии в веществе галогена. Окраска пламени обусловлена образованием летучих при высокой температуре галогенидов меди. Фторид меди нелетуч, поэтому фтор пробой Бельштейна не обнаруживается. Следует знать, что некоторые азотистые органические вещества, не содержащие галоген, также окрашивают пламя в зеленый цвет, по-видимому , в результате образования цианида меди.
Во многих случаях наличие галогена в алкилгалогенидах можно определить следующим образом: неизвестное вещество нагревают несколько минут со спиртовым раствором AgNO3. Галоген обнаруживают по выпадению осадка, который нерастворим в разбавленной азотной кислоте (винил- и арилгалогениды таким образом обнаружить не удастся).
Более общий случай обнаружения галогена в органическом соединении – сплавление органического вещества с натрием:
X + Na  Na+ X-
Na+ X-
X- + Ag+  Ag X
Ag X
При сплавлении органического галогенида с натрием образуются неорганические соли – галогениды натрия. Если к раствору такой соли добавить несколько капель нитрата серебра, то выпадает осадок галогенида серебра.
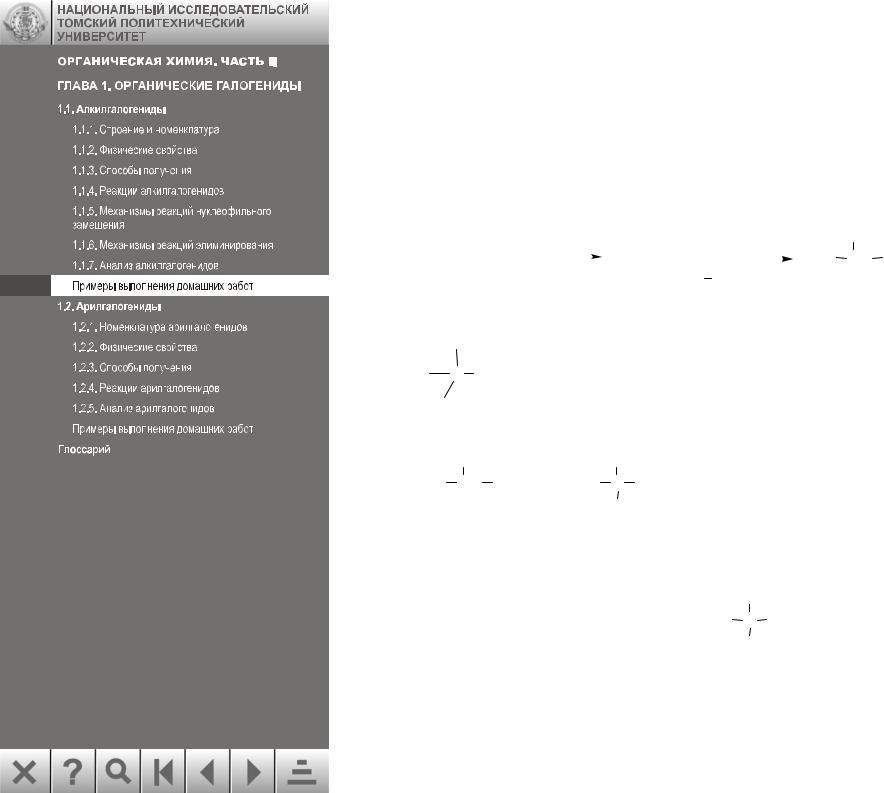
Примеры выполнения домашних работ
Задача 1.
Соединение состава C4H9I вступает в реакции замещения с KCN и NH3. Скорость реакций SN зависит только от концентрации C4H9I. При взаимодействии C4H9I с магнием в среде абсолютного эфира, а затем с водой, образуется изобутан. Установите структуру соединения и напишите реакции.
Решение:
|
|
|
|
H2O |
CH3 |
C H I + Mg |
|
C4H9MgI |
|
H3C CH CH3 |
|
|
|||||
|
|
||||
4 |
9 |
|
|
MgOHI |
|
изобутан
Так как конечным продуктом схемы является изобутан, исходный алкилгалогенид должен иметь изо-строение
C C C
Возможны два варианта:
CH3 |
CH3 |
H3C CH CH2I |
H3C C CH3 |
|
I |
(I) |
(II) |
Поскольку реакция зависит только от концентрации C4H9I, она протекает по механизму SN1, следовательно, структура C4H9I
CH3 H3C C CH3
I (II)

Задача 2.
При кипячении в воде
CH CH CH2
Cl
одним из продуктов реакции является
CH CH CH2 OH
Объясните причину получения этого продукта. Решение:
Замещение хлора гидроксигруппой проходит через образование карбокатиона аллильного типа, который подвергается перегруппировке. Каждый из катионов реагирует с водой с образованием двух изомерных спиртов:
CH CH CH2 |
C |
CH |
CH2 |
CH |
CH |
CH2 |
||
Cl |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
H2O |
|
|
|
|
||
|
CH |
CH |
CH2 |
CH |
CH |
CH2 O H |
||
|
O |
|
|
|
|
|
H |
|
H |
H |
|
|
|
|
|
|
|
|
|
+ |
Cl |
|
|
|
+ Cl |
|
CH |
CH |
CH |
2 |
+ HCl |
CH |
CH |
CH2 OH + HCl |
|
|
|
|
|
|
|
|
|
|
OH
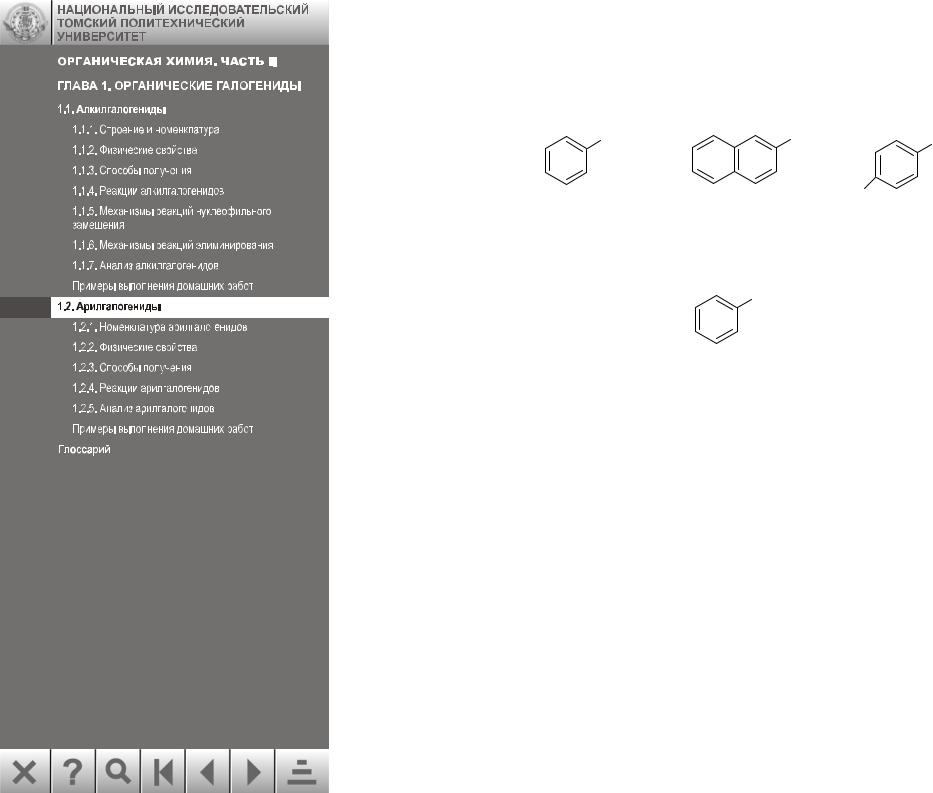
1.2. АРИЛГАЛОГЕНИДЫ
Арилгалогенидами называют соединения, содержащие атом галогена, связанный непосредственно с ароматическим кольцом:
Br |
Cl |
Cl |
|
|
H3C |
бромбензол |
β-хлорнафталин |
п-хлортолуол |
Хлористый бензил не является арилгалогенидом, т. к. галоген в нем не связан с ароматическим кольцом:
CH2Cl
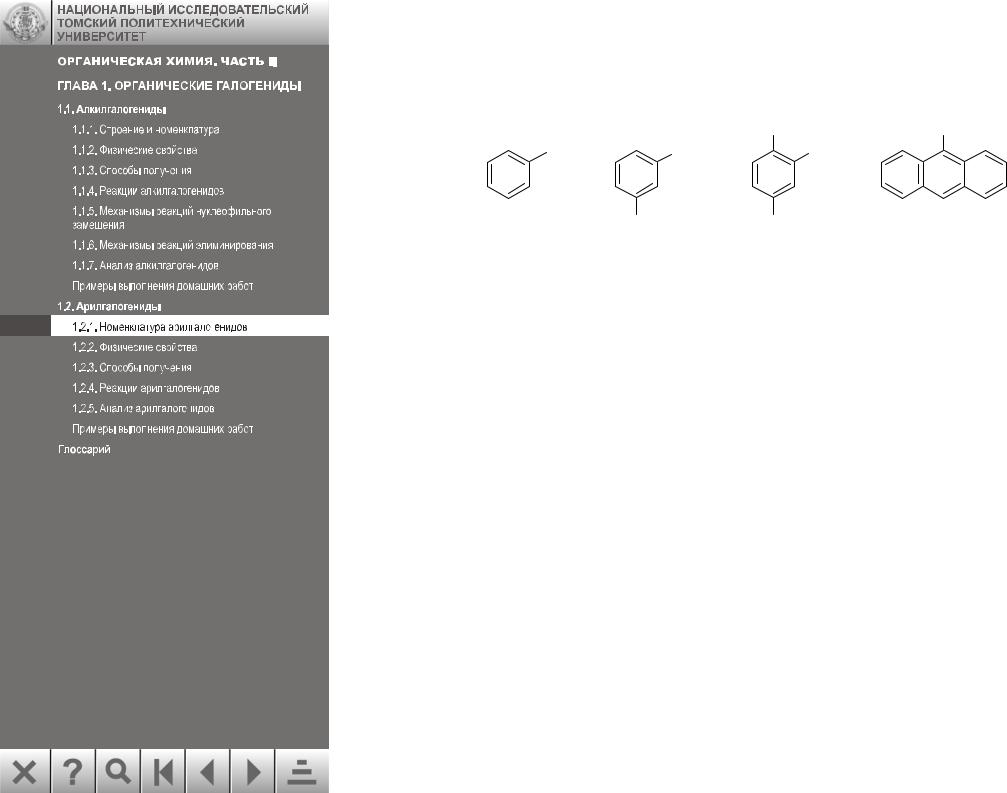
1.2.1. Номенклатура арилгалогенидов
Названия арилгалогенидов образуются путем прибавления названия заместителя к названию арена:
|
|
COOH |
Br |
I |
Br |
Cl |
|
Br |
Cl |
иодбензол м-дибромбензол 2,4-дихлорбен- 9-бромантрацен (1,3-дибромбензол) зойная кислота
