
- •7. Тепловые свойства твердых тел
- •7.3.Теория теплоёмкости Эйнштейна
- •7.4. Теория теплоёмкости Дебая
- •7.1. Особенности теплового движения в кристалле. Фононы
- •7.2. Теплоёмкость твердых тел
- •7.3.Теория теплоёмкости Эйнштейна
- •Случай высоких температур .
- •7.4. Теория теплоёмкости Дебая
- •7.6. Тепловое расширение твердых тел
- •7.7. Теплопроводность твердых тел Диэлектрики
- •7.7.2. Теплопроводность металлов
7.2. Теплоёмкость твердых тел
Закон
Дюлонга и Пти. Атомы в твердом
теле при любой температуре совершают
тепловые колебания около своих средних
положений равновесия. С ростом температуры
интенсивность теплового движения
увеличивается. При умеренно высоких
температурах этот рост
пропорционален
![]() .
.
Рассмотрим зависимость теплоёмкости твердого тела от температуры. Теплоёмкость вещества, относящаяся к 1 молю – это энергия, которую необходимо сообщить молю вещества, для того, что бы повысить его температуру на 1К, т.е. теплоёмкость при постоянном объёме
![]() .
.
В 1918 году французские физики Дюлонг и Пти экспериментально установили закон из которого следовало, что теплоёмкость всех твердых тел при высоких температурах есть величина постоянная, независящая от температуры и составляющая 25Дж/(моль·К), т.е. при нагревании любого твердого тела на 1К каждый его атом поглощает одно и то же количество энергии.
Классическая
физика даёт следующее объяснение этому
закону. Согласно закону равномерного
распределения энергии по степеням
свободы, на каждую степень свободы
системы приходится энергия
![]() ,
где
,
где
![]() - постоянная Больцмана, тогда средняя
энергия такой системы равна произведению
числа степеней свободы на
.
- постоянная Больцмана, тогда средняя
энергия такой системы равна произведению
числа степеней свободы на
.
Атомы твердого
тела совершают малые колебания около
положений равновесия в узлах кристаллической
решетки. При этом каждый атом колеблется
в трех взаимно перпендикулярных
направлениях, т.е. имеет три независимые
колебательные степени свободы. Такой
атом можно уподобить трем линейным
гармоническим осцилляторам. Средняя
кинетическая энергия осциллятора
(одной степени свободы) равна его средней
потенциальной энергии
.
Тогда средняя полная энергия осциллятора
равна
![]() .
.
Если кристалл
состоит из
![]() атомов (
атомов (![]() - число Авогадро), то он представляет
собой систему с 3
степенями свободы,
- число Авогадро), то он представляет
собой систему с 3
степенями свободы,
и его полная средняя тепловая энергия Е=3 .
Молярная
теплоёмкость
![]() ,
,
где R
- молярная газовая постоянная
(универсальная), R=8,314
Дж
![]() ;
;
тогда
![]() =3·8,314=25
Дж /моль ·К.
=3·8,314=25
Дж /моль ·К.
Этот результат хорошо согласуется с экспериментом.
В классической физике металл представляют как совокупность колеблющихся атомов и свободных электронов. Каждый электрон обладает тремя поступательными степенями свободы.
Тогда полная средняя тепловая энергия такой системы
![]() ,
,
где N - число свободных электронов.
В случае
одновалентного металла
![]() и
и
![]() .
.
Тогда =4,5R=37,6 Дж , т.е. в 1,5 раза больше значения, полученного экспериментально. Поэтому физики сделали вывод о том, что электроны не вносят вклада в теплоёмкость металла.
7.3.Теория теплоёмкости Эйнштейна
П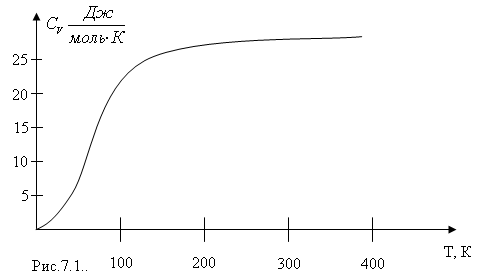 ри
низких температурах имеются значительные
отклонения от закона Дюлонга и Пти, и
температурная зависимость теплоёмкостей
твердых тел имеет вид, представленный
на рис.7.1.
ри
низких температурах имеются значительные
отклонения от закона Дюлонга и Пти, и
температурная зависимость теплоёмкостей
твердых тел имеет вид, представленный
на рис.7.1.
Теплоёмкость при низких температурах не является постоянной величиной, а увеличивается с ростом температуры от нуля до значения, определенного законом Дюлонга и Пти. Для объяснения такой зависимости теплоемкости от температуры классических представлений оказалось недостаточно, и необходимо привлекать представления квантовой статистики.
В 1907 г. Эйнштейн предложил модель, которая позволила качественно объяснить указанное поведение теплоемкости.
При выборе модели
он исходил
из гипотезы Планка,
согласно которой энергия
микроскопических тел (атомов, молекул)
может принимать только конечные
дискретные значения
![]() .
.
В твердом теле
энергетические уровни атомов, которые
рассматриваются как гармонические
осцилляторы, образуют некоторую лестницу,
состоящую из равноотстоящих ступеней
высотой
![]() ,
твердое тело представляет собой
совокупность одинаковых гармонических
осцилляторов (атомов), которые колеблются
независимо друг от друга с одинаковой
частотой
в трех взаимно перпендикулярных
направлениях. Энергия этих осцилляторов
квантована.
,
твердое тело представляет собой
совокупность одинаковых гармонических
осцилляторов (атомов), которые колеблются
независимо друг от друга с одинаковой
частотой
в трех взаимно перпендикулярных
направлениях. Энергия этих осцилляторов
квантована.
Эйнштейн показал, что средняя энергия квантового осциллятора равна
![]()
Тогда энергия
системы из
![]() атомов
атомов
 ,
,
а молярная теплоёмкость
 (7.1)
(7.1)
Рассмотрим предельные случаи.
