
- •Под редакцией в.В. Колпаковой
- •I. Органические соединения азота
- •Нитросоединения
- •2). Реакции, связанные с подвижностью α-атомов водорода.
- •3). Реакции с минеральными кислотами.
- •3. Перегруппировка амидов карбоновых кислот по Гофману:
- •Физические свойства
- •2. Алкилирование аминов.
- •Реакции аминов с азотистой кислотой.
- •В случае взаимодействия n,n-диметиламинобензола с азотистой кислотой механизм реакции выглядит следующим образом:
- •Реакции аминов с карбонильными соединениями.
- •Изонитрильная проба.
- •Синтезы на основе свойств солей диазония
- •Соли диазония.
- •II. Органические соединения серы введение
- •Соединения двухвалентной серы тиоспирты
- •Синтетические способы получения
- •Физические свойства
- •Химические свойства
- •Сульфиды
- •Способы получения
- •Химические свойства сульфокислот и их функциональных производных
- •Эфиры серной кислоты
- •Контрольные вопросы
- •11.1 Синтез и реакции меркаптанов (тиоспирты)
- •11.2 Способы получения и химические свойства ароматических сульфокислот
II. Органические соединения серы введение
Серосодержащие органические соединения прорабатываются студентами самостоятельно. В большинстве учебников сведения об этих веществах не излагаются компактно, а разбросаны по разным разделам, что сильно затрудняет усвоение материала.
Настоящие методические указания частично устраняют указанные недостатки. В них изложены все вопросы, связанные с серосодержащими соединениями в соответствии с рабочими программами всех технологических специальностей, читаемых в МГУПБ. Исключение составляют сернистые гетероциклы, которые рассматриваются в разделе «Гетероциклические соединения».
Существуют истинные сероорганические соединения, т.е. вещества, содержащие связи С – S, и эфиры серной кислоты, в их молекулах сера связана с углеродом через кислород С – О – S.
В большинстве сероорганических соединений сера либо двух- , либо шестивалентная.
Соединения двухвалентной серы тиоспирты
Аналогом гидроксильной группы ОН является сульфгидрильная (меркапто) группа SH. Вещества, содержащие эту группу, относятся к классам тиоспиртов и тиофенолов и объединяются общим названием – меркаптаны.
В природе меркаптаны образуются в небольших количествах при разложении белков и некоторых других веществ растительного и животного происхождения.
Синтетические способы получения
Взаимодействие галогеналканов с кислыми солями сероводорода:
CH3I + NaHS → CH3SH + NaI
2. Реакции солей диазония с гидросульфидами щелочных металлов:
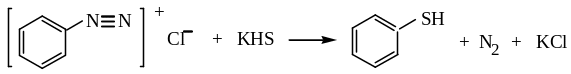
хлористый бензолдиазоний тиофенол
3. Восстановление сульфокислот:
R – SO3H + 6 [ H ] → R – SH + 3 H2O
Щелочное расщепление изотиурониевых солей:
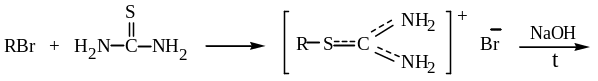
тиомочевина алкилизотиуронийбромид
![]()
Замещение гидроксильной группы спиртов на сульфгидрильную:
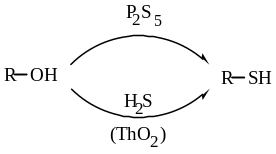
Физические свойства
Метилмеркаптан при комнатной температуре – газ, его температура кипения Ткип ≈ 8 ºС. Другие простейшие тиоспирты – жидкости, кипящие при более низких температурах, чем соответствующие спирты. Молекулы меркаптанов в меньшей степени ассоциированы за счет водородных связей. Тиофенолы – твердые кристаллические вещества.
Меркаптаны имеют крайне неприятный запах, проявляющийся даже в ничтожных концентрациях. Изоамилмеркаптан добавляют к природному газу для обнаружения утечки бытового газа.
Меркаптаны плохо растворимы в воде, но хорошо растворяются в спирте, эфире и других органических растворителях.
Плотность меркаптанов ниже единицы.
Химические свойства
Меркаптаны обладают более сильными кислотными свойствами, чем спирты и фенолы. Тиоспирты реагируют со щелочами, а также оксидами тяжелых металлов, образуя меркаптиды:
СH3CH2CH2SH + NaOH → CH3CH2CH2SNa + H2O
2 CH3CH2SH +HgO → (CH3CH2S) 2Hg + H2O
Меркаптиды можно алкилировать и ацилировать:
СH3CH2SNa + CH3I → СH3CH2 – S – CH3 + NaI
метилэтилсульфид
СH3CH2SNa + CH3СOCl → СH3COSСH2CH3 + NaI
этилтиоацетат
2. Тиоспирты значительно активнее, чем обычные спирты, реагируют с альдегидами и кетонами, образуя тиоацетали и тиокетали:

диэтилтиоацеталь бензальдегида

этилентиокеталь
циклопентанона
Гидрирование циклических тиокеталей на никеле – удобный способ восстановления кетонов, а также удаления органической серы из угле-водородов, так называемое, обессеривание.
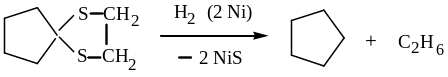
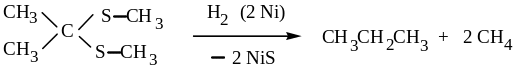
3. Меркаптаны легко окисляются. Такие слабые окислители, как серная кислота, йод и даже кислород воздуха, окисляют их до дисульфидов:
2 R – SH + I2 → R – S – S – R + 2 HI
Сильные окислители превращают меркаптаны в сульфокислоты:
C2H5SH + K2Cr2O7 → C2H5SO3H
этансульфокислота
