
- •Под редакцией в.В. Колпаковой
- •I. Органические соединения азота
- •Нитросоединения
- •2). Реакции, связанные с подвижностью α-атомов водорода.
- •3). Реакции с минеральными кислотами.
- •3. Перегруппировка амидов карбоновых кислот по Гофману:
- •Физические свойства
- •2. Алкилирование аминов.
- •Реакции аминов с азотистой кислотой.
- •В случае взаимодействия n,n-диметиламинобензола с азотистой кислотой механизм реакции выглядит следующим образом:
- •Реакции аминов с карбонильными соединениями.
- •Изонитрильная проба.
- •Синтезы на основе свойств солей диазония
- •Соли диазония.
- •II. Органические соединения серы введение
- •Соединения двухвалентной серы тиоспирты
- •Синтетические способы получения
- •Физические свойства
- •Химические свойства
- •Сульфиды
- •Способы получения
- •Химические свойства сульфокислот и их функциональных производных
- •Эфиры серной кислоты
- •Контрольные вопросы
- •11.1 Синтез и реакции меркаптанов (тиоспирты)
- •11.2 Способы получения и химические свойства ароматических сульфокислот
В случае взаимодействия n,n-диметиламинобензола с азотистой кислотой механизм реакции выглядит следующим образом:


Реакции аминов с карбонильными соединениями.
Ароматические амины легко конденсируются с альдегидами и кетонами по механизму AN.
C6H5CHO + H2NC6H5 ¾® C6H5 –CH=N–C6H5 + H2O
бензальанилин
Имины алифатических карбонильных соединений и алифатических аминов неустойчивы и быстро разлагаются или полимеризуются. Например, в реакции формальдегида с аммиаком не удается получить имин формальдегида (H2C=NH).

Уротропин – первое органическое соединение, строение которого установлено с помощью метода рентгеноструктурного анализа, применяется в качестве анитисептика и как сухое горючее.
Изонитрильная проба.
Образование изонитрилов (алкилкарбиламинов) при нагревании первичных аминов с хлороформом и спиртовым раствором гидроксида калия:
![]()
Первоначально из хлороформа при действии щелочи в результате -элиминирования образуется дихлоркарбен электронно-дефицитная частица с секстетом электронов у атома углерода. Затем происходит нуклеофильное присоединение амина к дихлоркарбену, после чего в результате последовательного отщепления двух молекул хлороводорода образуется изонитрил:


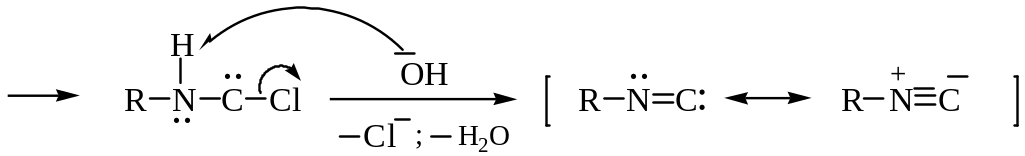
изонитрил (алкилкарбиламин)
Галогенирование первичных и вторичных алифатических аминов в слабощелочной среде приводит к N-галогенаминами:
Na2CO3
(CH3CH2)2NH + Cl2 ¾¾¾¾® (CH3CH2)2N–Cl
N-хлордиэтиламин
Ароматические амины легко галогенируются в ядро (SE).
8. Реакции окисления дают сложные смеси продуктов; случае анилина такая смесь окрашена в интенсивно черный цвет.
Наибольшее практическое значение имеет анилин. Анилин синтезируют в промышленном масштабе восстановлением нитробензола. Как основание он проявляет более слабые свойства, чем аммиак. Основные химические реакции представлены в таблице 2 на стр. 23.
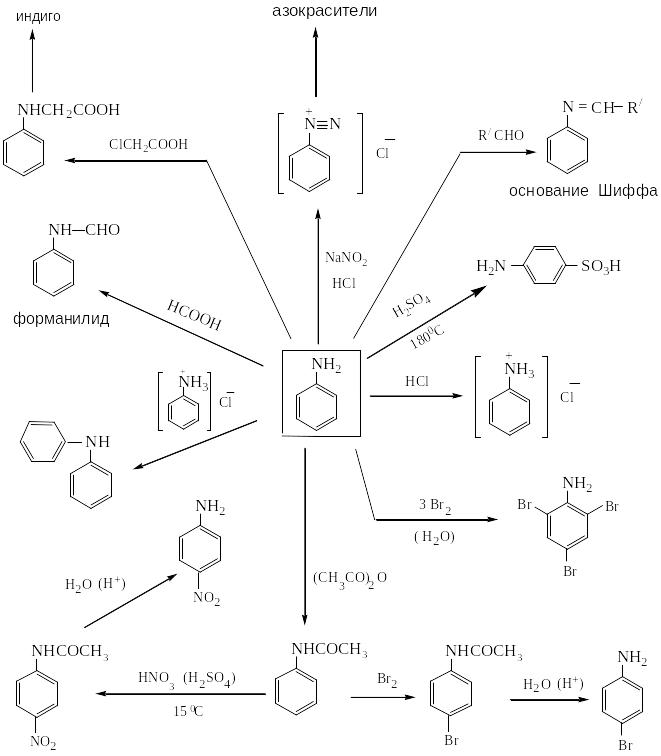
3. АЗО- И ДИАЗОСОЕДИНЕНИЯ
Синтезы на основе свойств солей диазония
● Пониженная реакционная способность арилгалогенидов в реакциях нуклеофильного замещения атома галогена ограничивает их применение для синтеза производных ароматического ряда.
● Особая ценность диазониевой группы заключается не только в разнообразии реакций замещения, но и возможности элиминироваться, замещаться на водород.
● Последняя реакция обычно завершает цепь превращений, в которых используется ориентирующее действие нитро- или аминогруппы, превращаемой затем в диазониевую.
● Для получения азокрасителей используют реакции солей диазония с ароматическими фенолами и аминами.
Соли диазония.
Способ получения ароматических диазосоединений (солей диазония) из первичных ароматических аминов и смеси нитрита натрия и минеральной кислоты называется диазотированием. Поскольку эта реакция экзотермичная, а образующиеся соли диазония при нагревании разлагаются, то реакционная смесь охлаждается до 0-10 С добавлением льда в реакционную массу.
ArNH2 + NaNO2 + 2 HCl ArN2+X- + NaCl + 2 H2O
Конец диазотирования определяется по посинению бумаги, пропитанной растворами KI и крахмала (йодо-крахмальная бумага). Азотистая кислота, находящаяся в избытке, окисляет I до свободного иода, вызывающего появление характерной окраски крахмала.
![]()
Соли диазония готовят непосредственно перед использованием. Повышение температуры способствует их распаду с выделением азота и отражается на чистоте и выходе продуктов дальнейших превращений. Избыток азотистой кислоты нежелателен, так как возможно нитрозирование азосоставляющей и конкуренция с реакцией азосочетания. Его можно устранить добавлением в реакционную массу после диазотирования сухой мочевины или сульфаминовой кислоты до прекращения выделения газов:

![]()
Электронодонорные заместители, увеличивающие электронную плотность в ароматическом ядре, стабилизируют арилдиазоний-катион. Диазониевая группа легко замещается на другие функциональные группы с образованием ароматических веществ различных классов, а также на атом водорода, приводящий к ее элиминированию (см. Схему ). Во всех реакциях выделяется азот, последняя реакция завершает цепь превращений, в которых используется ориентирующее действие нитро- или аминогруппы, превращающуюся затем в диазониевую. Этим нередко пользуются, учитывая доступность солей диазония и то, что пониженная реакционная способность арилгалогенидов в реакциях нуклеофильного замещения атома галогена ограничивает применение последних для синтеза производных ароматического ряда. Рассмотрим несколько примеров синтеза ароматических соединений использующие свойства солей диазония.
Пример 1. Синтез п-йодтолуола из п-толуидина:

Пример 2. Синтез о-броманизола из о-нитроанилина:


Пример 3. Синтез 3,4,5-трийод-1-нитробензола из 4-нитроанилина:

Схема . Синтезы на основе солей диазония.
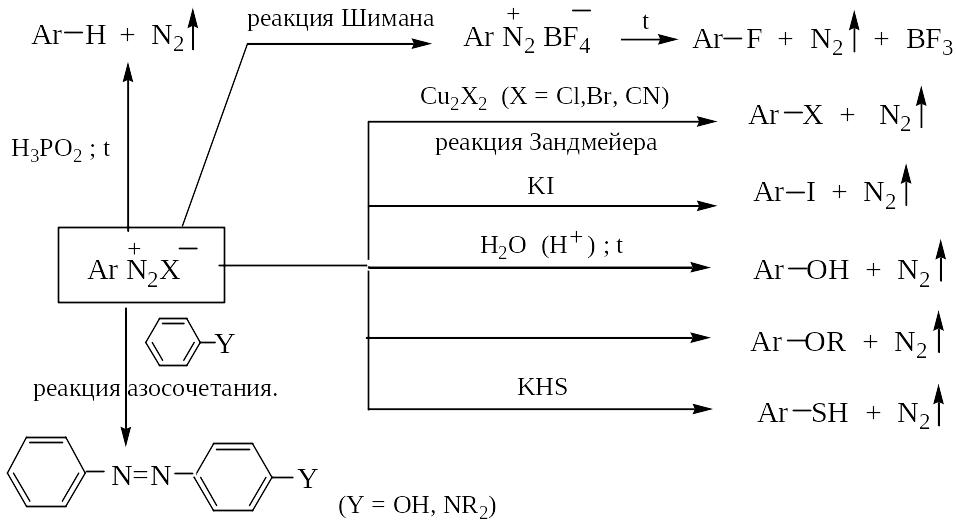
Для получения азокрасителей используют реакции солей диазония с ароматическими фенолами и аминами (реакция азосочетания).
Реакция азосочетания является реакцией электрофильного замещения (SE.), так как электроноакцепторные группы увеличивают, а электронодонорные группы снижают реакционную способность арилдиазоний-катиона. Электрофильный характер азосочетания подтверждается и тем, что при увеличении электронодонорности заместителей в ароматическом ядре скорость реакции возрастает.
Ароматические соединения, не содержащие в ядре сильных электронодонорных заместителей, как правило, не могут выступать в роли азокомпонентов


В сильнокислой среде (рН < 5) возможно протонирование групп азокомпонентов (ОН, NR2), обусловливающих их повышенную реакционную способность; при этом азокомпоненты утрачивают свою способность к азосочетанию:

При рН > 10 из диазосоставляющей образуется диазотат-анион, не обладающий электрофильными свойствами:
![]()
Фенолы наиболее активны в роли азокомпонентов в реакциях азосочетания в форме фенолят-аниона, а амины в непротонированной форме.
При азосочетании возможны следующие побочные реакции:
– разложение диазосоединения с выделением азота, скорость процесса при этом возрастает с повышением температуры и рН среды;
– переход диазосоединения в неактивный диазотат-анион ArN=NО (обычно в сильнощелочной среде);
– образование диазоаминосоединения при использовании в качестве азосоставляющего компонента амина. Реакция может быть основной при диазотировании недостатком азотистой кислоты в нейтральной или щелочной среде:


диазоаминобензол
Ниже приведены примеры получения азокрасителей из ароматических аминов путем превращения их в соли диазония (реакция диазотирования) и последующим взаимодействием ее с ароматическими фенолами или аминами (реакция азосочетания):
Пример 1. Получение 2-нафтолоранжа из сульфаниловой кислоты.

реакция диазотирования
 диазониевая
соль реакция азосочетания
2-нафтолоранж
диазониевая
соль реакция азосочетания
2-нафтолоранж
Пример 2. Получение метилоранжа из сульфаниловой кислоты.
реакция диазотирования
 реакция
азосочетания (I)
реакция
азосочетания (I)

(II)
В зависимости от рН среды азокрасители приобретают различную окраску, Так, индикаторные свойства метилоранжа обусловлены таутомерией: в щелочной среде он желтого цвета (бензоидная форма – II), в кислой красного (хиноидная форма – I).
.
Алифатические диазосоединения.
Важное значение в синтетической практике имеет диазометан.
Строение диазометана может быть описано рядом резонансных структур:
![]()
Диазометан получают обработкой спиртовым раствором КОН эфирного раствора N-нитрозометилуретана
![]()
N-нитрозо-N-метил-п-толуолсульфамида:
![]()
N-нитрозометилмочевины (ниже приведен механизм этой реакции):
![]()



Диазометан легко метилирует соединения, содержащие активный атом водорода (с галогеноводородами дает метилгалогениды, с карбоновыми кислотами, сульфокислотами и фенолами их метиловые эфиры). Метилирование органических соединений связано с его способностью легко давать диазониевый катион:
![]()
В прис. AlCl3 (или BF3) диазометан реагирует с альдегидами образуя метилкетоны. Также он способен к расширению цикла в циклических кетонах. C диазометаном обычно работают в растворах (эфир, бензол).
Диазометан используют в синтезе АрндтаЭйстерта, позволяющем удлинять цепь углеродных атомов в молекуле карбоновой кислоты. Ниже приведена схема синтеза α-нафтилуксусной кислоты из α-нафтойной кислоты:

