
- •Технологія конструкційних матеріалів та матеріалознавство
- •Київ кнутд 2004
- •Будова та властивості металів та сплавів План:
- •Кристалізація План:
- •Пластична деформація та рекристалізація металів і сплавів. План:
- •1. Напруга і деформація. Руйнування металу.
- •2. Механізм пластичної деформації.
- •Діаграма стану
- •Діаграми стану, їхнє значення.
- •Правило відрізків.
- •Діаграми склад-властивості (Курнакова - Матисена).
- •Залізовуглецеві сплави Діаграма стану залізовуглецевих сплавів. План:
- •Вторинна кристалізація.
- •В залежності від концентрації вуглецю та структури, сталі й чавуни поділяють на:
- •Термічна обробка металів і сплавів План:
- •Сполучення гартування з відпуском чи старінням практично завжди
- •Термічна обробка сталі
- •Ізотермічне перетворення переохолодженого аустеніту
- •Мартенситне перетворення в сталі
- •3. Перетворення при відпуску сталі
- •Технологія термічної обробки План:
- •Відпал і нормалізація сталі.
- •Гартування, відпуск сталі, обробка сталі холодом.
- •Термомеханічна обробка сталі і термічна обробка чавунів.
- •Поверхневе зміцнення сталі
- •1. Поверхневе гартування.
- •2. 3Міцнення шляхом пластичного деформування.
- •3. Хіміко-термічна обробка.
- •Cплави кольорових металів.
- •Електрорадіотехнічні матеріали.
- •Провідникові матеріали.
- •Напівпровідники.
- •Магнітні матеріали.
- •Неметалічні матеріали. План
- •1.Загальні поняття.
- •2.Класифікація полімерів.
- •3.Особливості властивостей полімерних матеріалів.
- •Корозія металів і методи захисту від неї. План:
- •1.Корозія, її основні види.
- •Залізовуглецеві сплави……..……………………………………...………22
Корозія металів і методи захисту від неї. План:
1.Корозія, її основні види.
2.Способи захисту металів від корозії.
1. Корозією - називають руйнування металів під дією навколишнього середовища. У результаті впливу зовнішнього середовища механічні властивості металів різко погіршуються, іноді навіть при відсутності видимої зміни зовнішнього вигляду поверхні.
Розрізняють корозію хімічну, що протікає при впливі на метал газів (газова корозія) і неелектролітів (нафта, її похідні), і електрохімічну, викликану дією електролітів: кислот, лугів і солей. До електрохімічної корозії відносяться також атмосферна і ґрунтова.
Х
Товщина
плівки![]() ,
SОз,
СО
,
Н
S
і інші. Метал, контактуючи з газами,
вступає з ними в хімічну взаємодію, у
результаті чого на поверхні утвориться
плівка оксидів у вигляді FeO,
FeS
і т.д. Плівки оксидів на металі утворяться
також і при дії на нього рідин. Корозія
починається з поверхні (на границі фаз
метал - зовнішнє середовище) і з часом
поширюється в глиб металу, приводячи
до необернених втрат. Швидкість протікання
корозії змінюється з часом. Спочатку
при безпосередньому контакті газу з
металом оксидна плівка росте інтенсивно
(о - а). Потім товщина плівки росте з
уповільненою швидкістю (а - б), що вказує
на деяку захисну дію плівки проти
корозії. З часом корозія сповільнюється
(б -
,
SОз,
СО
,
Н
S
і інші. Метал, контактуючи з газами,
вступає з ними в хімічну взаємодію, у
результаті чого на поверхні утвориться
плівка оксидів у вигляді FeO,
FeS
і т.д. Плівки оксидів на металі утворяться
також і при дії на нього рідин. Корозія
починається з поверхні (на границі фаз
метал - зовнішнє середовище) і з часом
поширюється в глиб металу, приводячи
до необернених втрат. Швидкість протікання
корозії змінюється з часом. Спочатку
при безпосередньому контакті газу з
металом оксидна плівка росте інтенсивно
(о - а). Потім товщина плівки росте з
уповільненою швидкістю (а - б), що вказує
на деяку захисну дію плівки проти
корозії. З часом корозія сповільнюється
(б -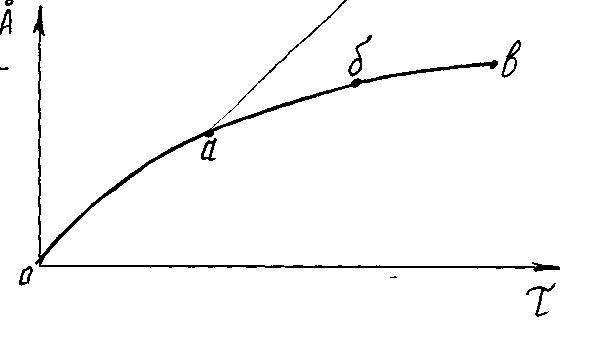 в), але не припиняється, тому що оксидні
плівки до деякої міри проникні для
зовнішнього
середовища.
в), але не припиняється, тому що оксидні
плівки до деякої міри проникні для
зовнішнього
середовища.
Мал.39
Хімічна корозія характеризується товщиною і властивостями оксидної плівки, а також швидкістю протікання процесу. Товщина плівки визначається тривалістю процесу і температурою.
1.Товсті
плівки (>5000
![]() )
виявляються візуально;
)
виявляються візуально;
2.Плівки середньої товщини ( 400 - 500 ) виявляються на
металі у виді кольорів побіжності;
3.Тонкі плівки (< 400 ) виявляються непрямим методом.
З підвищенням температури швидкість дифузії газів збільшується і тому хімічна корозія протікає інтенсивніше з утворенням на поверхні металу товстої плівки оксидів, називаною окалиною.
Електрохімічна корозія являє собою процес руйнування металу в електроліті. Електролітами можуть бути водяні розчини солей, кислот, лугів, а також вода. Цей вид корозії є найбільш розповсюдженим. Більшість металевих конструкцій у процесі експлуатації знаходяться в зіткненні з повітрям. У повітрі знаходяться водяні пари, вуглекислота, сірчаний газ і інші домішки, що розчиняються в крапельках вологи. У результаті поверхня металевих конструкцій покрита вологою, насиченої солями, лугами і кислотами, тобто тонким шаром електроліту, у зв'язку з чим і виникає електрохімічна корозія.
Розглянемо процес електрохімічної корозії. При зануренні металу в електроліт, що представляє собою розчини солей того ж металу, одночасно будуть протікати два процеси:
- перехід атомів металу в розчин ;
- зворотний процес переходу іонів металу з розчину на поверхню металу.
У залежності від співвідношення швидкостей протікання обох процесів можливі три різних випадки поводження металів в електроліті.
1-й випадок - швидкість переходу атомів металу в розчин менше швидкості переходу іонів металу з розчину на зразок.
У цьому випадку на поверхні зразка осаджуються позитивно заряджені іони металу. Зразок у цілому заряджається електрододатньо і процесу корозії не відбувається.
2-й випадок - швидкість переходу атомів у розчин дорівнює швидкості переходу іонів металу з розчину на поверхню зразка. У цьому випадку зразок металу залишається електронейтральним і процес корозії також не спостерігається.
3-й випадок - швидкість переходу атомів у розчин більше швидкості переходу іонів металу з розчину на зразок. У цьому випадку метал, віддаючи позитивні іони, заряджається електровід’ємно. При цьому відбувається розчинення металу, тобто протікає процес корозії.
Значить у випадку електрохімічної корозії кородуючий метал заряджається електровід’ємно. Якщо корозії не відбувається, то метал залишається електронейтральним чи заряджається електрододатньо. Кількісною характеристикою відносини металу до корозії є величина електрохімічного потенціалу, що різна для різних металів. За порядком убування електрохімічного потенціалу всі метали можуть бути розташовані в наступний ряд :
Метал Аu Аg Сu Н Ni Fе Zn Аl Мg
Електродний
потенціал в, в +1,42 +0,8 +0,34 0 -0,23 -0,44 -0,76 -1,66 -2,38
 Метали,
що мають позитивний електрохімічний
потенціал не кородують, а з негативним
потенціалом піддаються корозії. Тому
для запобігання корозії необхідно, щоб
весь сплав чи його поверхневий шар мали
позитивний електрохімічний потенціал.
При з'єднанні двох металів у пари в
електроліті буде кородувати той, котрий
заряджається більш электровід’ємно.
Метали,
що мають позитивний електрохімічний
потенціал не кородують, а з негативним
потенціалом піддаються корозії. Тому
для запобігання корозії необхідно, щоб
весь сплав чи його поверхневий шар мали
позитивний електрохімічний потенціал.
При з'єднанні двох металів у пари в
електроліті буде кородувати той, котрий
заряджається більш электровід’ємно.
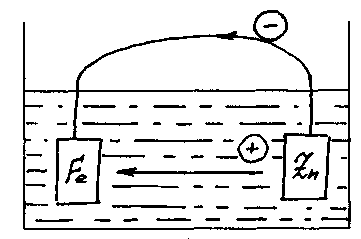
Мал.40
Наприклад при зануренні Fе і Zn в електроліт обидва метали починають розчинятися заряджаючи при цьому электровід’ємно Zn. Так як Zn заряджається більш электро-від’ємно, то при з’єднанні в пари електрони по зовнішньому ланцюзі підуть від Zn до Fе, а іони в зв'язку з цим одержать спрямований рух від Zn до Fе. Значить у цій парі кородувати (розчинятися) першим буде більш електронегативний Zn.
Метал, що має більше значення електрохімічного потенціалу, не буде кородувати доти, доки цілком не розчиниться метал з меншим (більш електронегативний) значенням електрохімічного потенціалу. У сплаві, що складається з зерен різних фаз, кожна пара зерен утворить гальванічний мікроелемент, а реальний сплав можна розглядати як багато-електродний гальванічний мікроелемент.
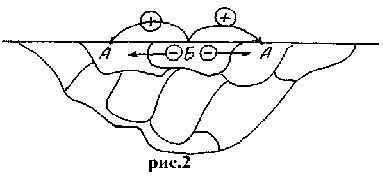 Мал.41
Мал.41
Якщо електрохімічний потенціал фази А більше електрохімічного потенціалу фази Б, то електричний струм потече від зерен фази Б к зернам фази А через метал, а позитивно заряджені іони - від фази Б через електроліт до фази А. У результаті в такому сплаві зерна однієї фази (Б) будуть розчинятися, а іншої (А) залишатися незмінними, з чого можна зробити висновок про необхідність одержання однорідної однофазної структури сплавів для забезпечення найбільш високих антикорозійних властивостей.
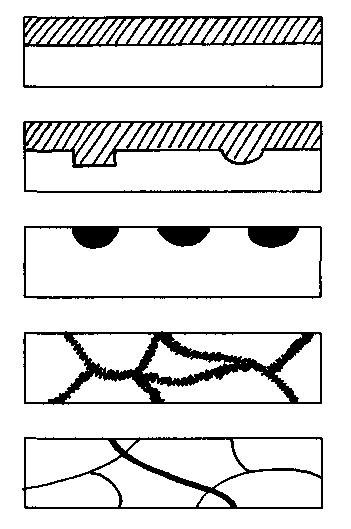
1. Рівномірну чи загальну
2. Нерівномірну
3. Місцеву
4. Міжкристалічну
5. Транс-кристалічну
6. Під навантаженням.
При рівномірній корозії розчинення металу протікає по всій поверхні виробу приблизно з однаковою швидкістю. Такий вид корозії спостерігається, якщо метал однорідний, наприклад однорідний твердий розчин.
У неоднорідному металі, що зустрічається частіше, корозія протікає на різних ділянках поверхні з неоднаковою швидкістю, тобто нерівномірно. Найчастіше зустрічається в багатофазних сплавах.
Місцева корозія відбувається на окремих ділянках поверхні металу і підрозділяється на крапкову, плямисту і з виразками, що розвиваються на обмеженій площі, але на велику глибину.
Найбільш небезпечна міжкристалічна корозія, що поширюється по границях зерен унаслідок більш низького їхнього електрохімічного потенціалу. Корозія без помітних зовнішніх ознак швидко розвивається по границях зерен, усередину, різко знижуючи механічні властивості.
При транс-кристалічній (виборчій) корозії, руйнуванню піддаються лише деякі структурні складові металу, тоді як інші корозійному руйнуванню не піддаються чи руйнування відбувається по визначених кристалографічних напрямках ( наприклад, по напрямку ліній ковзання).
Корозія під навантаженням виникає при одночасній дії корозійного середовища і розтягуючих навантажень, що розподіляються в металі нерівномірно і викликають нерівномірну корозію по границях зерен (латунь, А1 і Fе сплави), чи по напрямку ліній ковзання в кристалах (деякі нержавіючі сталі, що випробують під напругою фазові перетворення).
Різні види корозійного руйнування можуть бути на одній і тій ж поверхні металу одночасно, підсилюючи руйнуючу дію на нього.
2. Методи захисту металів і сплавів від корозії можна розділити на чотири групи:
1. Захист обробкою зовнішнього середовища;
2. Електрохімічний захист;
3. Захисні покриття;
4. Легування.
1. Сутність методів захисту від корозії обробкою зовнішнього середовища полягає у видаленні з її реагентів збудників корозії, чи уведення в зовнішнє середовище інгібіторів - спеціальних речовин, що нейтралізують шкідливу дію реагентів і сповільнюють корозію.
Наприклад: Випал металу при високих температурах здійснюється в атмосфері зі зменшеним змістом О , у безокисній чи нейтральній атмосфері, у якій подають газоподібний азот, що захищає метал від окислювання.
2.Електрохімічний захист металу від корозії здійснюється за допомогою протектора.
Наприклад: У морській воді створюється гальванічна пара з металу, що захищається, і протектора - іншого більш електронегативного металу контактуючого з виробом, що захищає. У такій парі метал протектора - анод (-) руйнується, захищаючи від корозії метал виробу - катод (+). Такий захист звичайно застосовують для конструкцій, що працюють у морській воді, використовуючи як протектор Zn, сплави Аl + Мg, Аl+Zn, Сd+Zn, Аl і інші метали.
Цинк - найбільш розповсюджений метал для протекторів при захисті залізних і дюралюмінієвих сплавів. У морській воді відношення поверхні протектора (-) до поверхні конструкції, що захищається, береться в межах від 1/200 до 1/1000, відстань між протекторними пластинами - 2-3 метра.
Електрохімічний захист застосовують для суднових, котелень установок, підземних трубопроводів, що координують, заряджаючи при цьому элктро-від’ємно. Для створення позитивного заряду виріб підключають до негативного полюса генератора постійного струму. Виріб при цьому стає катодом і припиняє кородувати.
3. Покриття, застосовувані для захисту металевих виробів від корозії можна розділити на три групи:
- Металеві (Zn,Аl, Рb, Sn, Сd, Cu, Ni, Сr, Аg, Аu і їхні сплави);
- Неметалічні захисні покриття - фарби, лаки, емалі, пластмаси, гуми, смоли, цементи і т.д.
В даний час лакофарбові антикорозійні покриття складають приблизно 65% усіх захисних покрить металевих виробів.
Покриття пластмасами емалями, гумою, цементом застосовують в основному в хімічній промисловості, як кислототривкий захист.
-Покриття захисними оксидними плівками відносяться до хімічних покрить. На поверхні металевих виробів штучно створюють захисні оксидні плівки. Оксидуванню піддають як чорні, так і кольорові метали.
Фосфатування сталевих виробів роблять у розчинах фосфорнокислих солей. У результаті на поверхні металу утвориться плівка інертних фосфорнокислих солей, що захищає виріб від впливу зовнішнього середовища.
4.3ахист металів від корозії методом легування заснован на підвищенні електрохімічного потенціалу сплаву при введенні в нього легуючих елементів.
Так наприклад, введення в Fе хрому в кількості 12-14% приводить до того, що електрохімічний потенціал сталей стає електропозитивним. Тому нержавіючі сталі (12X13, 12X17, 15X28, 12Х18Н9, 17Х18Н9, 12Х18Н10Т) стійкі проти корозії в атмосфері, воді, ряді кислот, солей, лугів.
Корозійна стійкість металів при рівномірній корозії оцінюється відповідно до ДЕРЖСТАНДАРТУ по десятибальній шкалі.
Усі метали і сплави по швидкості корозії ( у мм/ рік ) розділені на 6 груп стійкості ( зовсім стійкі, майже стійкі, стійкі, зниженої стійкості, легко-стійкі і нестійкі) і оцінюються відповідним балом (1й бал - швидкість корозії менш 0,001 мм/рік, 2й -0,001-0,005, 10й - 10 мм/рік).
Зміст
Будова та властивості металів та сплавів................................................ 3
Кристалізація……………………………………………………………… 7
Пластична деформація та рекристалізація металів і сплавів……… .11
Діаграми стану……………………………………………………………...16
