
- •Технологія конструкційних матеріалів та матеріалознавство
- •Київ кнутд 2004
- •Будова та властивості металів та сплавів План:
- •Кристалізація План:
- •Пластична деформація та рекристалізація металів і сплавів. План:
- •1. Напруга і деформація. Руйнування металу.
- •2. Механізм пластичної деформації.
- •Діаграма стану
- •Діаграми стану, їхнє значення.
- •Правило відрізків.
- •Діаграми склад-властивості (Курнакова - Матисена).
- •Залізовуглецеві сплави Діаграма стану залізовуглецевих сплавів. План:
- •Вторинна кристалізація.
- •В залежності від концентрації вуглецю та структури, сталі й чавуни поділяють на:
- •Термічна обробка металів і сплавів План:
- •Сполучення гартування з відпуском чи старінням практично завжди
- •Термічна обробка сталі
- •Ізотермічне перетворення переохолодженого аустеніту
- •Мартенситне перетворення в сталі
- •3. Перетворення при відпуску сталі
- •Технологія термічної обробки План:
- •Відпал і нормалізація сталі.
- •Гартування, відпуск сталі, обробка сталі холодом.
- •Термомеханічна обробка сталі і термічна обробка чавунів.
- •Поверхневе зміцнення сталі
- •1. Поверхневе гартування.
- •2. 3Міцнення шляхом пластичного деформування.
- •3. Хіміко-термічна обробка.
- •Cплави кольорових металів.
- •Електрорадіотехнічні матеріали.
- •Провідникові матеріали.
- •Напівпровідники.
- •Магнітні матеріали.
- •Неметалічні матеріали. План
- •1.Загальні поняття.
- •2.Класифікація полімерів.
- •3.Особливості властивостей полімерних матеріалів.
- •Корозія металів і методи захисту від неї. План:
- •1.Корозія, її основні види.
- •Залізовуглецеві сплави……..……………………………………...………22
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ КИЇВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ТЕХНОЛОГІЙ ТА ДИЗАЙНУ
В. П. Анішин
Технологія конструкційних матеріалів та матеріалознавство
Конспект лекцій
для студентів спеціальності 6.0902 “Інженерна механіка” з дисципліни “Технологія конструкційних матеріалів та матеріалознавство. Частина 2.” денної та заочної форм навчання
Всі цитати, цифрові, фактичний матеріал і бібліографічні відомості перевірені. Зауваження рецензентів враховані. |
Вимогам, що пред’являються до навчально-методичної літератури відповідає. До друку і в світ дозволяю на основі § 2, п. 15 (Єдиних правил...) |
Позиція плану № _______ Замовлення № _______ Тираж _______ екз. Підписи упорядника (ів) “____” __________ 200__ р. |
Проректор Ю. Є. Кулєшов “____” __________ 200__ р. М. П. |
Відомості, що заборонені для відкритої публікації нема.
І відділ Проректор Ю. Ю. Щербань
“____” __________ 200__ р. “____” __________ 200__ р.
М. П.
Затверджено
на засіданні кафедри________
протокол №_______ від_______ 200 р.
Зав. кафедри_____________________
“____” __________ 200__ р.
Київ кнутд 2004
УДК 621.7/.9(075.8)
Технологія конструкційних матеріалів та матеріалознавство: Конспект лекцій для студентів спец. 6.0902 „інженерна механіка” з дисципліни „технологія конструкційних матеріалів та матеріалознавство” денної та заочної форми навчання. Даний конспект лекцій може бути використаний для студентів, спеціальності 6.0925 „Автоматизація технологічних процесів та виробництв” з дисципліни „Матеріалознавство і обробка матеріалів”, для студентів спеціальності 6.0913 „Метрологія та вимірювальна техніка” з дисципліни „Електротехнічні та конструктивні матеріали” і студентів зі спеціальністю 6.0922 „Електромеханіка” з курсу технологія машинобудування та конструкційні матеріали. Упор.: В.П. Анішин
К:КНУТД.2004.-72с.
Упорядники – В.П. Анішин, канд. техн. наук, доц.
Рецензенти – В.Г. Клімась, канд. техн. наук, доц.
Відповідальний за випуск – зав. Кафедрою інженерної механіки
О.Н. Хом’як доктор технічних наук, професор.
Затверджено на засіданні кафедри інженерної механіки протоколом
№____від___________2004р.
Будова та властивості металів та сплавів План:
Основні властивості металів, обумовлені їх будовою.
Атомно-кристалічна будова металів.
Загальні поняття про дислокації.
Загальні методи дослідження матеріалів.
1. Метали широко використовуються в природі. З відомих в наш час 109 хімічних елементів періодичної системи Менделєєва 79 є металами. Великий російський вчений М.В. Ломоносов першим дав найбільш ясне визначення металів. Він писав: “Метали світлі тіла, які кувати можна.” В наш час до цього основного признаку металів слід додати ще їх високу електро- та теплопровідність, а також позитивний температурний ефект електроопору (при збільшенні температури електроопір чистих металів зростає), термоелектронну емісію (здатність випромінювати електрони при нагріванні), збільшену здатність до пластичних деформацій.
Метали відрізняються від інших твердих тіл, неметалів (металоїдів), деяким сполученням хімічних, фізико-механічних, технологічних та експлуатаційних властивостей. З хімічних властивостей металів найбільш специфічною є здатність, з’єднуючись з киснем та водою, як правило, створювати основи (луги) на відміну від металоїдів, що утворюють кислоти. Іонізуючись , атоми металу втрачають зовнішні валентні електрони і набувають позитивного заряду. Хімічна взаємодія може здійснюватися, як між різними за зарядом атомами (метал-металоїд), так і між однаковими (металоїд-металоїд, метал-метал). Цим трьом типам хімічних взаємодій відповідають три основних види міжатомних зв’язків: іонний, ковалентний, металічний. Іонний зв’язок характеризується взаємодією різнойменно заряджених іонів (Na+ Cl-). При ковалентному зв’язку між спареними електронами, які належать декільком атомам виникають сили електромагнітної взаємодії (Cl2,O2). Металічний зв’язок виражається у взаємодії електростатичних сил притягування між позитивно зарядженими іонами і колективізованими електронами і у взаємному відштовхуванні однойменних частинок (іонів та електронів). Особливістю атомної будови металів є наявність в них особливого типу міжатомного зв’язку - металічного, який характеризується тим, що вільні електрони, які переміщуються між іонами належать не одному якомусь атому, а “колективізовані” – пов’язані з багатьма атомами. Металічний тип зв’язку визначає відмінні фізичні властивості металів: металічний блиск, пластичність, високі електро- і теплопровідність. Висока електропровідність металів пояснюється тим, що електрони в металах слабо зв’язані з атомним ядром і легко відділяються від нього. Тому навіть невелика різниця потенціалів може викликати в металі переміщення електронів - створюється електричний струм. Характерною рисою металів, яка відрізняє їх від інших речовин, що також мають електронну провідність, є підвищення електропровідності зі збільшенням температури. Теплопровідність металів пояснюється не лише переміщенням електронів, але і коливальним рухом іонів.
З атомною будовою металів тісно пов’язані їх властивості. Теоретично мірою міцності кристалічної ґратки при руйнуванні є величина міжатомного зв’язку. Зміна величини міжатомного зв’язку може характеризуватися зміною теплоти сублімації (випаровування), міжатомної відстані, амплітуди коливання іонів, температури плавлення, іншими фізичними величинами. Чисельні значення фізико-механічних властивостей технічних металів і їхніх марок приводяться в ДСТУах і довідниках. Володіючи високими фізико-механічними і технологічними властивостями, метали і їх сплави є основними матеріалами, що застосовуються в техніці для виготовлення конструкцій, деталей машин і інструментів.
2. Правильна гранка вільно зростаючих кристалів ще в XIX столітті привела Е. С. Федорова до думки про правильне розташування в просторі атомів, що утворять ці кристали. Застосування Лауе рентгенівських променів у 1912 році дозволило отримати експериментальний доказ справедливості цих уявлень.
У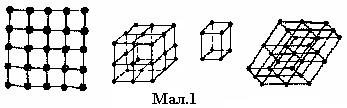 сі
метали і їх сплави у твердому стані є
кристалічними тілами. Основна ознака
кристалічних тіл - їх правильна внутрішня
будова, що виражається в тому, що атоми
(іони) розташовуються в просторі у
певному порядку, утворюючи кристалічну
ґратку. На малюнку 1 показане розміщення
атомів в одній із кристалографічних
площин.
сі
метали і їх сплави у твердому стані є
кристалічними тілами. Основна ознака
кристалічних тіл - їх правильна внутрішня
будова, що виражається в тому, що атоми
(іони) розташовуються в просторі у
певному порядку, утворюючи кристалічну
ґратку. На малюнку 1 показане розміщення
атомів в одній із кристалографічних
площин.
У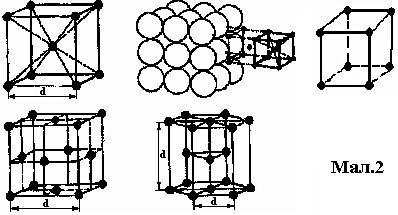 явні
лінії, проведені через центри атомів,
умовно зображених у вигляді кружків,
утворять ґратку. Багаторазове повторення
подібних кристалографічних площин,
розташованих паралельно, дає уявлення
про просторову кристалічну ґратку,
вузли якої є місцями розташування
атомів. Ще в 1890-1891 році кристалограф
Е.С.Федоров теоретично встановив закони
розташування молекул, атомів та іонів
у просторі і довів можливість існування
230 просторових груп і 7 систем (сингоній)
явні
лінії, проведені через центри атомів,
умовно зображених у вигляді кружків,
утворять ґратку. Багаторазове повторення
подібних кристалографічних площин,
розташованих паралельно, дає уявлення
про просторову кристалічну ґратку,
вузли якої є місцями розташування
атомів. Ще в 1890-1891 році кристалограф
Е.С.Федоров теоретично встановив закони
розташування молекул, атомів та іонів
у просторі і довів можливість існування
230 просторових груп і 7 систем (сингоній)
розташування часток речовини в просторі. У металів найбільш поширеними кристалічними ґратками є кубічні (об'ємо- і гранецентровані), тетрагональні і гексагональні (мал.2). Наприклад: Fe, Al, Cu мають кубічні гратки; Zn, Mg, Cd, Be – гексагональні; In,Sbβ – тетрагональні.
Розміри елементарної кристалічної комірки характеризуються найменшими відстанями між атомами, які називаються параметрами або періодами ґратки. Величина параметрів кристалічних ґраток металів коливається в межах від 1 до 7 Å (1Å = 10-10 м). В залежності від зовнішніх умов (температури і тиску) метали можуть кристалізуватися, утворюючи різні кристалічні форми. Це явище отримало назву алотропії чи поліморфізму. Різні кристалічні форми речовини називають її алотропічними модифікаціями і позначають буквами грецького алфавіту α, β, γ та ін. Буквою α позначається модифікація, стійка при найнижчій температурі (Feαоцк, 768Feβ, 91Feγтцк, 1400Feδоцк).
Основними характеристиками просторових кристалічних ґраток є базис гратки та її координаційне число.
Базис кристалічної гратки складають атоми, які належать одній елементарній комірці. Враховуючи повторення елементарних кристалічних комірок по всьому об’єму кристала можна визначити число атомів, які приходяться на долю кожної комірки. Наприклад, в ОЦК-гратці кожен з 8 атомів, що знаходяться у вузлах гратки входить до складу 8 інших елементарних комірок. Тільки атом, який знаходиться в центрі, належить даній елементарній комірці. Таким чином, на долю елементарної комірки приходиться два атоми (8:8+1=2). В ГЦК – (Б=8:8+6:2=4).
Іншою характеристикою кристалічної гратки є координаційне число – число атомів, що знаходяться на однаковій, найближчій відстані від даного атома. В кубічній – К=6 , в ОЦК – К=8, в ГЦК – К=12.
Координаційним числом і базисом гратки визначається більшість властивостей металів, в першу чергу, їх густина. Чим більше координаційне число і базис, тим більша густина (компактність) гратки. Найбільш щільні – ГЦК і гексагональна щільно спакована гратка (координаційне число – 12).
Приведені схеми кристалічних граток не означають, що атоми знаходяться в статистичній рівновазі, нерухомому стані. Для просторової кристалічної гратки металів характерні два види руху складових її частинок:
Переміщення електронів між позитивно зарядженими іонами (цей вид руху зумовлює електро - і частково теплопровідність металів).
Коливання атомів (іонів), розташованих у вузлах гратки навколо деякої середньої точки (цей вид руху зумовлює, в основному, теплопровідність металів).
При нагріванні металу до температури плавлення, амплітуда і швидкість коливань іонів зростає настільки, що кристалічна гратка руйнується, метал переходить з твердого стану в рідкий – розплавлений.
3. Застосування сучасних методів досліджень показує , що реальна кристалічна гратка металів відрізняється від ідеальної схеми наявністю кристалічних недосконалостей, що виявляється у відхиленні від правильного геометричного стану. Дефекти будови підрозділяються на точкові, лінійні і поверхневі. До точкових дефектів відносяться: вакансії (вузли гратки, не зайняті атомами) і атоми інших елементів (завжди є в складі металів), розташовані в міжвузлях гратки.
Основними лінійними дефектами є дислокації (більша протяжність в одному вимірі , при малих розмірах – у двох інших вимірах).
Поверхневі недосконалості малі тільки в одному вимірі. Вони являють собою поверхні розподілу між окремими зернами або блоками полікристалічного металу. Ступінь впливу різних видів кристалічних недосконалостей на властивості металів різна. Так, вплив вакансій порівняно невеликий. Навпаки, навіть невелика кількість домішок, що вносить багато інородних атомів до кристалічної гратки металу, спричиняє в ній безліч неоднорідностей. Найважливішою недосконалістю є дислокації, що визначають багато фізико-механічних властивостей металів.
4. Методи дослідження складу, структури і властивостей металів і сплавів і вивчення перетворень, що в них протікають, розділяють на дві групи:
I. Структурні методи дослідження (макро -, мікро -, рентгено -, електронно -, нейтронографічний аналіз).
II. Методи дослідження механічних, фізичних, хімічних властивостей (механічні випробовування, термічний, дилатометричний, магнітний аналіз, вимірювання внутрішнього тертя, теплових і електричних властивостей, метод радіоактивних ізотопів, хімічний, карбідний, інтерметалідний аналізи та ін.).
Велике значення для практики мають технологічні та експлуатаційні властивості металів та сплавів. До технологічних властивостей відносяться деформація або пластичність, ливарні властивості (усадка, рідко-текучість, заповненість форм), оброблення різанням, загартованість та ін. До експлуатаційних – зносостійкість, стійкість до корозії, красно стійкість.
Найпростіший метод дослідження структури металів – спостереження виду зламу. Він дає змогу встановити величину зерна металу (мілко - чи крупнозерниста будова). Однак метал може мати приховано-кристалічний або волокнистий злам, при якому визначення величини зерна стає неможливим.
Інший спосіб визначення будови металу – дослідження макроструктури, коли можна виявити пузирі , пустоти , тріщини. Після травлення шліфованої поверхні можна спостерігати кристалічну будову, фізичну та хімічну неоднорідність металу (збільшення до 40 разів).
Мікроаналіз здійснюється на полірованих зразках під оптичним мікроскопом при збільшенні від 50 до 2000 разів. Таке збільшення дає можливість виявити частинки величиною 10-5 м.
Все частіше для дослідження структури застосовують електронний мікроскоп, в якому для просвітлення використовують пучок електронів. Електронний мікроскоп дає збільшення в 250000 разів, однак , при вивченні структури металу часто використовують збільшення в 9000 – 15000 тис разів, що дає змогу визначити частинки розмірами 10-8 – 10-9 м. При цьому можна роздивитися деякі більш тонкі деталі, межі фрагментів, блоки мозаїки.
Найтонший метод дослідження внутрішньої будови металу – рентгеноструктурний, заснований на дифракції рентгенівських променів рядами атомів у кристалічній гратці. Він дозволяє визначити міжатомні відстані порядку 10-10 м. Цим методом можна встановити форму кристалічної гратки та величину відстані між атомами в гратці. Просторове розміщення атомів відтворюється на рентгенограмі. Кожний метал дає систему ліній, яка належить лише йому, лінії характеризуються певним розміщенням, шириною та інтенсивністю.
Для дослідження внутрішньої будови металу використовують також дифракцію електронів і нейтронів – електроно - і нейтронографічний методи.
Спектральний аналіз дозволяє встановити хімічний склад металічних сплавів по спектру, що одержують при свіченні їх у розжареному стані. Коли метали або сплави розжарені до стану газу або пари, вони дають характерну для кожного елементу лінію спектра (натрій – жовту).
Метод дозволяє виявити наявність елементів у сплаві, навіть якщо його кількість мізерно мала, а також визначити кількість елементу по інтенсивності спектральної лінії. Цей метод знайшов широке застосування в промисловості як простий, точний та продуктивний.
Призначення досліджень механічних властивостей металів (на зразках певних розмірів і форми та на спеціальних машинах або приладах) моделювати в якомусь ступені процес дії зовнішніх сил.
Фізико-хімічні методи дослідження були вперше застосовані Н.С. Курнаковим при розробці діаграм стану сплавів. Результатом цих робіт було встановлення зв’язку між складом, структурою та фізичними властивостями сплавів.
Термічний аналіз базується на виділенні або поглинанні тепла при внутрішніх перетвореннях , що проходять в металах і сплавах.
Цим методом визначають температури фазових перетворень (критичні точки), наприклад: ТКРИСТАЛІЗАЦІЇ і ТАЛОТРОПІЧНИХ ПЕРЕТВОРЕНЬ.
Дилатометричний метод застосовується в основному для визначення критичних температур фазових і структурних перетворень, що проходять в металах та сплавах в твердому стані. Метод базується на зміні довжини зразка, яке викликається об’ємними змінами в металах і сплавах при нагріванні та охолодженні.
Технологічні випробовування дозволяють визначити можливість проведення різних технологічних операцій. До цих випробовувань відносяться: випробовування на згин у холодному стані, осадку, перегин, видавлювання, зварюваність та ін. Для визначення поведінки металів в умовах експлуатації проводять випробовування на опір корозії, зносостійкість, красно-стійкість та ін. Проведення їх обумовлюється відповідними ДСТУ і ТУ.
