
- •1. Алкени. Гомологічний ряд алкенів.
- •Електронна будова подвійного зв’язку
- •Ізомерія
- •Одержання
- •Фізичні властивості
- •Хімічні властивості
- •Алкадієни. Реакція полімеризації. Полімери. Одержання, властивості і застосування пластмас.
- •Застосування
- •Дієнові вуглеводні (алкадієни). Типи алкадієнів.
- •Одержання алкадієнів
- •Хімічні властивості алкадієнів
- •Полімеризація дієнових сполук
- •Добування
- •Фізичні властивості алкінів
- •Хімічні властивості
- •I. Реакції приєднання:
- •1) Гідрування:
- •2) Галогенування:
- •Застосування
- •Ароматичні вуглеводні (арени)
- •Будова молекули бензолу (бензену)
- •Гомологи бензолу. Ізомерія. Гомологи бензолу можна розглядати як похідні бензолу, в яких один або декілька атомів вуглецю заміщені різними вуглеводневими радикалами.
- •Фізичні властивості
- •Хімічні властивості
- •І. Реакції заміщення:
- •1) Галогенування
- •Правила орієнтації в бензольному ядрі
Застосування
Ацетилен НС≡СН – безбарвний газ, без запаху, погано розчиняється у воді, горить яскравим, сильно кіптявим полум’ям, з повітрям утворює вибухові суміші. При згоранні ацетилену в кисні виділяється велика кількість тепла (3000°С). Це дозволяє використовувати ацетилен для автогенного зварювання і різання металів.
Ароматичні вуглеводні (арени)
АРОМАТИЧНІ ВУГЛЕВОДНІ (арени) – це вуглеводні циклічної будови, молекули яких містять бензольне кільце. |
Арени мають загальну формулу CnH2n-6.
Будова молекули бензолу (бензену)
Бензол має склад молекули С6Н6 і належить до групи ароматичних вуглеводнів. Ця назва, як і багато інших в органічній хімії, склалася історично, оскільки перші з добутих сполук цієї групи справді мали приємний запах.
Будова молекули бензолу багато років становила теоретичну проблему, жодна із запропонованих структурних формул не відповідала властивостям речовини, що спостерігалася вченими в лабораторії.
Німецький
учений А. Кекуле запропонував формулу,
що найкраще відобразила рівноцінність
і атомів Карбону, і атомів Гідрогену:
![]() .
Проте і ця формула неповністю відповідає
реальній структурі молекули бензолу.
Після з’ясування електронної будови
молекули бензолу формулу почали
записувати таким чином:
.
Проте і ця формула неповністю відповідає
реальній структурі молекули бензолу.
Після з’ясування електронної будови
молекули бензолу формулу почали
записувати таким чином:
![]() .
Цю формулу запропонував Полінг. Мається
на увазі, що атоми карбону розміщуються
в кутах шестикутника і сполучені з
атомами гідрогену. Кільце всередині
шестикутника показує, що в молекулі
існує єдина шестиелектронна хмара,
утворена електронами, наданими у спільне
користування шістьма карбоновими
атомами (по одному електрону кожним
атомом). Зв’язки між атомами Карбону
не є простими чи подвійними в чистому
вигляді. Через це бензол не належить ні
до насичених, ні до ненасичених
вуглеводнів, а є представником нової
групи – ароматичних вуглеводнів.
.
Цю формулу запропонував Полінг. Мається
на увазі, що атоми карбону розміщуються
в кутах шестикутника і сполучені з
атомами гідрогену. Кільце всередині
шестикутника показує, що в молекулі
існує єдина шестиелектронна хмара,
утворена електронами, наданими у спільне
користування шістьма карбоновими
атомами (по одному електрону кожним
атомом). Зв’язки між атомами Карбону
не є простими чи подвійними в чистому
вигляді. Через це бензол не належить ні
до насичених, ні до ненасичених
вуглеводнів, а є представником нової
групи – ароматичних вуглеводнів.
Для позначення молекули бензолу найчастіше користуються формулою Кекуле, пам’ятаючи про її недосконалість.
Гомологи бензолу. Ізомерія. Гомологи бензолу можна розглядати як похідні бензолу, в яких один або декілька атомів вуглецю заміщені різними вуглеводневими радикалами.
Найближчий гомолог бензолу – С6Н5СН3 метилбензол (толуол); як і бензол, толуол не має гомологів. Наступний гомолог бензолу С6Н4(СН3)2 – диметилбензол (ксилол) має три ізомери, які відрізняються положенням метильних груп. Скорочення „о-”, „м-”, „п-” означають „орто-”, „мета-”, „пара-”:
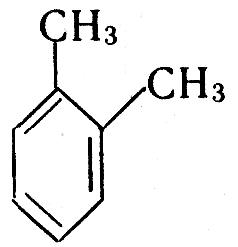
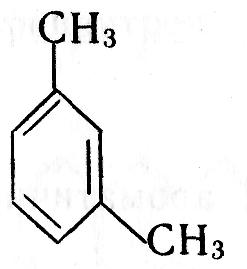
![]()
о-диметилбензол м-диметилбензол п-диметилбензол
орто-ксилол мета-ксилол п-ксилол
1,2-диметилбензол 1,3-диметилбензол 1,4-диметилбензол
В орто-положенні метильні групи знаходяться біля сусідніх атомів вуглецю, в мета-положенні – через один атом вуглецю, в пара-положенні – через два.
При заміщенні одного атома водню на радикал вініл (-СН=СН2) утворюється вінілбензол або стирол С6Н5-СН=СН2. Стирол легко полімеризується, утворюючи полістирол. При полімеризації відбувається розрив подвійного зв’язку вінілу.
