
- •Физика пласта.
- •1. Коэффициенты проницаемости горной породы. Единицы измерения и методы определения.
- •2. Коэффициенты пористости горных пород. Единицы измерения и методы определения.
- •3. Относительные фазовые проницаемости горных пород для двухфазных систем.
- •4. Зависимость коэффициентов пористости и проницаемости от давления.
- •5. Состав и свойства природных газов.
- •6. Состав и свойства нефтей.
- •7. Понятие упругости насыщенных паров углеводородов. Примеры применения.
- •8. Коэффициент сверхсжимаемости (сжимаемости) реальных газов.
- •9. Уравнение состояния реальных газов.
- •10. Критическое давление и температура компонента и смеси газов. Приведенные параметры смеси газов.
- •11. Растворимость газа в жидкости. Закон Генри.
- •12. Классификация нефтей по структурно-механическим свойствам.
- •13. Гидраты природных газов и их влияние на процессы разработки месторождений.
- •14. Движение нефти, газа и воды в пористой среде. Закон фильтрации Дарси.
- •15. Деформационные свойства горных пород. Сжимаемость коллекторов нефти и газа.
- •16. Деформация коллекторов при разработке нефтяных и газовых месторождений.
9. Уравнение состояния реальных газов.
Идеальным наз-ся газ, собственный объем молекул которого пренебрежимо мал по сравнению с объемом, занимаемым газом и между молекулами которого отсутствует взаимодействие. Коэф-т сверхсжимаемости и. г. равен 1. Состояние идеальных газов описывается уравнением Менделеева-Клапейрона:
PV=RT,
Где P – давление в Па; V – объем газа в м3; - количество газа в кмоль; R – универсальная газовая постоянная (R = 8,31434*103 Дж/кмоль.К).
Уравнение Менделеева-Клапейрона для реальных газов справедливо лишь при низких давлениях. Поэтому для описания состояния реальных газов – уравнение Ван-Дер-Ваальса и др.
Уравнение Ван-Дер-Ваальса:
(P+a/V2)(V-b)=RT,
где b – собственный объем молекул газа; a – сила притяжения молекул.
Сложность использования уравнения при практических расчетах заключается в том, что чаще встречаются смеси газов, для которых уравнение Ван-Дер-Ваальса применимо с трудом.
При большом числе компонентов, расчеты становятся трудоемкими. Поэтому для расчета часто пользуются обобщенным газовым законом Менделеева-Клапейрона, в которое вводится поправка (коэффициент сжимаемости), учитывающая отклонение реальных газов от законов сжатия и расширения идеальных газов:
PV=zmRT.
m – масса газа в кг.
Коэффициенты сжимаемости газов определяют обычно по экспериментальным графикам. Коэффициенты сжимаемости на таких графиках поставлены в зависимости от приведенного давления и температуры, которые определяются по формулам:
PПР=P/yiPКРi; TПР=T/yiTКРi; где уi - молярная доля i-го компонента в смеси.
10. Критическое давление и температура компонента и смеси газов. Приведенные параметры смеси газов.
Критические температура и давление дают приблизительное представление о том, в какой области давлений и температур эта смесь (или компонент) может существовать как жидкость, газ или двухфазная смесь. Критические параметры смеси вычисляются как взвешенная сумма критических параметров компонентов:
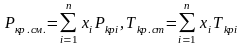 ,
где n-число
компонентов в смеси, xi-молярная
доля итого компонента в смеси газов,
Ркр.i,Т
кр.i-
критические значения параметров итого
компонента (из таблиц).
,
где n-число
компонентов в смеси, xi-молярная
доля итого компонента в смеси газов,
Ркр.i,Т
кр.i-
критические значения параметров итого
компонента (из таблиц).
Удобным -является представление уравнений состояния в приведенных переменных. Установлено, что при одинаковых значениях приведенных параметров различные газы имеют одинаковые физические и гидродинамические показатели, в нем и заключается принцип соответственных состояний.
В случае индивидуальных компонентов приведенные параметры — это безразмерные отношения параметров состояния газа к их критическим значениям. Например, приведенные давление Рпр= р/рхр, температура Тпр=Т/Тхр.
Таким же образом определяются приведенные объем, плотность и другие параметры.
Уравнение состояния, записанное с приведенными параметрами, становится универсальным. Так, например, уравнение Ван-дер-Ваальса при использовании приведенных параметров, приобретает вид
![]()
Это уравнение одинаково для всех индивидуальных газов. Для смеси газов приведенные параметры обычно вычисляются с использованием правила аддитивности:
![]()
