
- •Физика пласта.
- •1. Коэффициенты проницаемости горной породы. Единицы измерения и методы определения.
- •2. Коэффициенты пористости горных пород. Единицы измерения и методы определения.
- •3. Относительные фазовые проницаемости горных пород для двухфазных систем.
- •4. Зависимость коэффициентов пористости и проницаемости от давления.
- •5. Состав и свойства природных газов.
- •6. Состав и свойства нефтей.
- •7. Понятие упругости насыщенных паров углеводородов. Примеры применения.
- •8. Коэффициент сверхсжимаемости (сжимаемости) реальных газов.
- •9. Уравнение состояния реальных газов.
- •10. Критическое давление и температура компонента и смеси газов. Приведенные параметры смеси газов.
- •11. Растворимость газа в жидкости. Закон Генри.
- •12. Классификация нефтей по структурно-механическим свойствам.
- •13. Гидраты природных газов и их влияние на процессы разработки месторождений.
- •14. Движение нефти, газа и воды в пористой среде. Закон фильтрации Дарси.
- •15. Деформационные свойства горных пород. Сжимаемость коллекторов нефти и газа.
- •16. Деформация коллекторов при разработке нефтяных и газовых месторождений.
7. Понятие упругости насыщенных паров углеводородов. Примеры применения.
Насыщенный пар представляет собой двухфазную систему –смесь жидкости и пара с граничными значениями х=0 и х=1, где х- паросодержание смеси. Нсостояние насыщенного пара вполне определяется давлением (или температурой) и паросодержанием. Если углеводороды содержатся в смеси, то общее давление в смеси влияет на упругость паров каждого компонента. Упругость паров компонента повышается с увеличением общего давления. Это влияние ничтожно при низких давлениях ( до 1 Мпа ), при высоких же давлениях упругость паров резко увеличивается. У индивидуально углеводорода в чистом виде упругость паров – функция только температуры Q=f(t). У смеси углеводородов упругость паров – функция температуры и общего давления, т.е. Q=f(t,P). Упругость паров жидкой смеси (т.е. общее её давление ) по закону суммы парциональных давлений зависит от упругости паров отдельных компонентов при данной температуре и от их молярных концентраций. Парциальное давление каждого компонента определяется как произведение его малярной концентрации на упругость паров в чистом виде. Сумма же парциальных давлений всех компонентов равна общему давлению над смесью или упругости паров жидкой смеси.
Изменение упругости паров двухкомпонентной системы

АД – линия парциальных давлений низкокипящего компонента (н.к.к.), более летучего. В точке А его концентрация и парциальное давление равны 0, в этой точке жидкость состоит из одного высококипящего компонента (в.к.к.). ВС – линия парциальных давлений высококипящего копмонента. Обе эти линии для углеводородных смесей можно принять прямыми. СД – линия общего давления или упругости паров жидкой смеси, к-я зависит от состава смеси. Возьмём смесь с концентрацией х низкокипящего компанента ( точка Е ). Парциальное давление н.к.к. будет измеряться отрезком ЕG, а высококипящего – отрезком ЕF. Эти отрезки соответственно равны FH и HG , а EG+EF=GH.
8. Коэффициент сверхсжимаемости (сжимаемости) реальных газов.
Для определения многих физических свойств природных газов (коэффициента сжимаемости, плотности, энтальпии, энтропии, коэффициента летучести и др.) используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающая поведение простого или сложного вещества. В качестве таких параметров используется давление, объём и температура.
Менделеев-Клайперон предложили следующее уравнение состояния идеальных газов:
pV = GRT,
где p – абсолютное давление, Па; V – объём, м3; G – масса вещества, кг; T – абсолютная температура, К; R – удельная газовая постоянная, кДж/(кг·К).
Идеальным называют газ, силами взаимодействия между молекулами которого пренебрегают.
С термодинамической точки зрения идеальным называется газ, для которого справедливы равенства:

где Е – внутренняя энергия преобразования, Дж/моль.
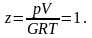
Здесь z – коэффициент, характеризующий степень отклонения реального газа от закона идеальных газов (коэффициент сверхсжимаемости).
Экспериментально доказано, что все реальные газы не подчиняются закону идеальных газов.
Реальные природные газы – физические смеси большого числа углеводородных и неуглеводородных компонентов, простых и сложных газов. Молекулы простых газов (метан, гелий, аргон, криптон и др.) имеют сферическую форму, а молекулы сложных газов и жидкостей – несферическую. Для простых газов силы притяжения, действующие вдоль линии, соединяющей центры сферических молекул, пропорциональны расстоянию в шестой степени. Для сложных газов и жидкостей силы притяжения (или отталкивания) между различными группами молекулярных пар не могут быть представлены лишь одной силой притяжения между центрами молекул. Для учёта других, нецентрических сил вводится ацентрический фактор ω. Он является третьим после приведённого давления и температуры параметром, оценивающим меру отклонения коэффициента сверхсжимаемости природных газов от его значения, определяемого классической двух параметрической теоремой соответственных состояний:
z = z (pпр, Tпр, ω),
или
zсм = z0(pпр, Tпр) + z1(pпр, Tпр) ωсм,
где z0(pпр, Tпр) – коэффициент сверхсжимаемости простого газа, определяемый pпр и Tпр при ω=0; z1(pпр, Tпр) – поправка к обобщённому коэффициенту сверхсжимаемости сложных газов и жидкостей, являющаяся функцией только приведённого давления и температуры; ωсм – ацентрический фактор смеси газов,

где ωi – ацентрический фактор i–го компонента смеси. Часто он определяется по формуле Эдмистера:

Здесь pат – атмосферное давление; Ткип – температура кипения компонента при атмосферном давлении.
