
Константа равновесия реакции изотопного обмена
Пусть дана реакция типа: A2+B2=2AB где A и B символы двух изотопов одного и того же элемента. Примерами таких реакций являются:
H2+D2=2HD
(18)
![]() (19) Для константы
равновесия реакции типа (18, 19) имеем:
(19) Для константы
равновесия реакции типа (18, 19) имеем:
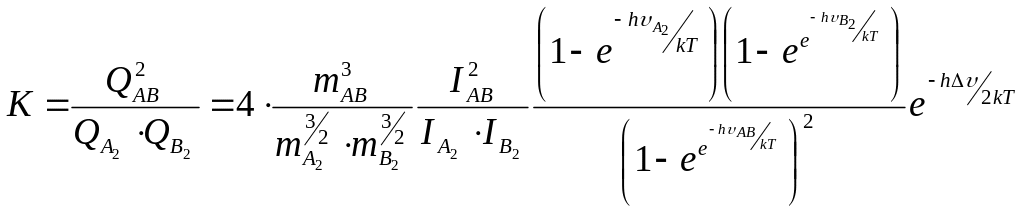 (21)
(21)
При низких температурах, когда h v » kT , выражение в круглых скобках близко к единице. Тогда
 (22)
(22)
Наоборот, при
достаточно высоких температурах, когда
выражение
![]() примет классическое значение Е/hvi.
Тогда при достаточно высоких температурах
имеем:
примет классическое значение Е/hvi.
Тогда при достаточно высоких температурах
имеем:
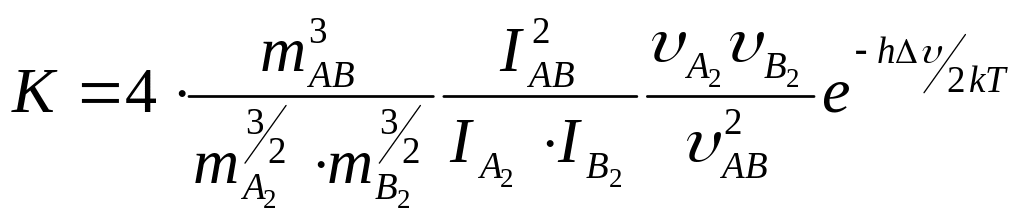 (23)
(23)
Отношение сумм по состояниям молекул.
Если уровни колебательной энергии в достаточной степени приближаются к гармоническим, то для средних и высоких температур, когда KT велико по сравнению с расстояниями между уровнями вращательной энергии, отношение сумм по состояниям в случае 2-х атомных молекул будет равно:
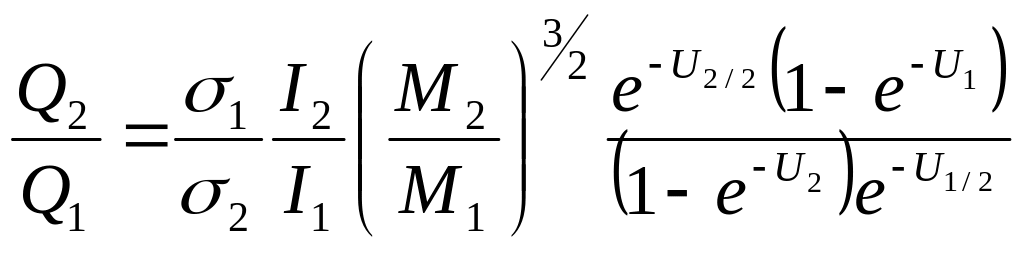 (24)
(24)
Для многоатомных молекул, имеющих Зп-х. Нормальных колебаний, получим:
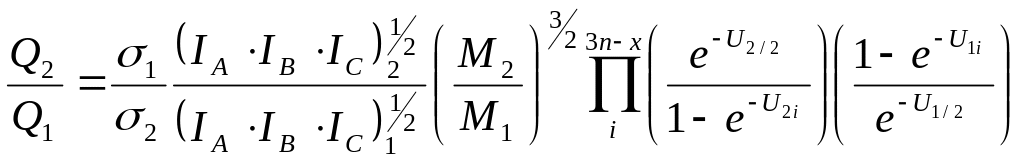 (25)
(25)
В этих уравнениях M1 и M2 представляют молекулярные веса изотопических разновидностей молекул, пропорциональные их массам, величины Ui, называемые приведёнными частотами, связаны с основными частотами колебаний соотношениями вида:
Ui=hvi/kT (26)
Расчёт отношений сумм по состояниям по уравнению (25) не всегда может быть выполнен для сложных многоатомных молекул. Затруднения, связанные с отсутствием экспериментальных данных о моментах инерции второй изотопической разновидности молекул, могут быть преодолены, а выражения (24) и (25) значительно упрощены при использовании правила произведения частот, предложенного Теллером и Редлихом. Это правило применимо для всех видов симметрии и для всех колебаний по теореме Теллера и Редлиха:
 (27)
(27)
где ot| и т-^ атомные веса, an- число обменивающихся изотопных атомов.
Вводя в уравнение (27) отношение U1/U2 и U1i/U2i вместо υ1/υ2 и υ1i/υ2i, получим
 (28)
(28)
 (29)
(29)
Подставляя эти выражения в уравнение (16) и (17) найдём отношение сумм по состояниям двухатомных и изотопических разновидностей молекул:
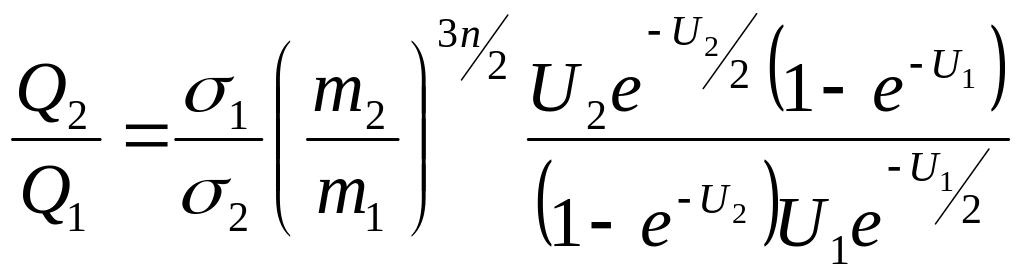 (30)
(30)
для многоатомных изотопических разновидностей молекул:
 (31)
(31)
определив отношение Q2/Q1 c помощью этих формул, можно далее на основании соотношения (21) вычислить значения К. С небольшим ущербом для точности можно упростить вычисления, если воспользоваться приближёнными методами расчёта констант равновесия реакции изотопного обмена, разработанными независимо друг от друга М.В.Татевским и Бигеляйзином и Майер.
Методы расчёта констант равновесия Метод Бигеляйзена и Майера
Вычисление константы равновесия реакции изотопного обмена можно упростить, если вместо Q2/Q1 ввести производные:
 (32)
(32)
Легко показать, что константа равновесия будет равна отношению величин f1/f2 в
соответствующих степенях:
Пусть в реакции aA1+bB2=aA2+bB1 (33)
в молекулах A1 и A2 обменивается n1 атомов, в молекулах B1 и B2 – n2 атомов данного изотопа.
Общее число обменивающихся атомов в реакции (33) будет n1a+n2b.
Так, для реакции обмена О18 и О16 между О16 и Н2О18
n1=2 a=1 n2=1 b=2
На основании формулы (32) имеем:
 (34)
(34)
 (35)
(35)
Определяя из этих
выражений
 и
и
 и подставляя их в уравнение (21) найдем:
и подставляя их в уравнение (21) найдем:
 (36)
(36)
откуда в силу равенства (35)
 (37)
(37)
Нетрудно убедиться, что величина f, определяется формулой (32), представляет отношение констант равновесия образования изотопических молекул из атомов в газообразной фазе.
Бигеляйзен и Майер
показали, что![]() (38) где
(38) где![]() (39)
(39)
При изменении Ui от 0 до ∞ величина изменяется от 0 до 0,5. Значения функции J вычислены Бигеляйзеным и Майер для разных возможных значений Ui.
Расчетная часть.
Дана реакция изотопного обмена:
H2O18 + 0,516О2= H2O16 + 0,518О2
Соединение |
H2О16 |
Н2О18 |
О216 |
О218 |
||||||||
Частота |
3825 |
1654 |
3936 |
3816 |
1648 |
3919 |
1580 |
1490 |
||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
|
|
|
||||||||||
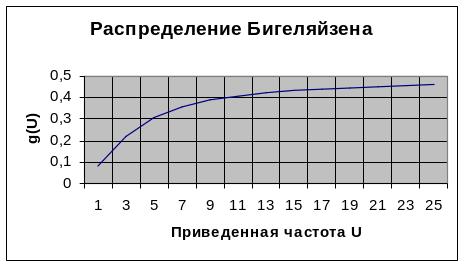
U |
J |
1 |
0,081977 |
2 |
0,156518 |
3 |
0,219062 |
4 |
0,268657 |
5 |
0,306784 |
6 |
0,335818 |
7 |
0,358056 |
8 |
0,375336 |
9 |
0,389012 |
10 |
0,400045 |
11 |
0,409108 |
12 |
0,416673 |
13 |
0,423079 |
14 |
0,428572 |
15 |
0,433334 |
16 |
0,4375 |
17 |
0,441177 |
18 |
0,444444 |
19 |
0,447368 |
20 |
0,45 |
21 |
0,452381 |
22 |
0,454545 |
23 |
0,456522 |
24 |
0,458333 |
25 |
0,46 |
Решение:
Приведенная частота изменяется в пределах от 1 до 25.
Построим функцию Бигеляйзена. ; (1)
|
Т, К |
||
ω |
710 |
750 |
790 |
1580 |
3,204507 |
3,0336 |
2,88 |
1490 |
3,021972 |
2,8608 |
2,7159494 |
3825 |
7,757746 |
7,344 |
6,9721519 |
1654 |
3,354592 |
3,17568 |
3,0148861 |
3936 |
7,982873 |
7,55712 |
7,174481 |
3816 |
7,739493 |
7,32672 |
6,9557468 |
1648 |
3,342423 |
3,16416 |
3,0039494 |
3919 |
7,948394 |
7,52448 |
7,1434937 |
![]()
Найдем f1
и f
2по
формуле
![]() и вычислим
и вычислим
![]() при различных температурах:
при различных температурах:
|
T=710K |
T=750K |
T=790K |
f1 |
1,022611 |
1,0209507 |
1,01946822 |
f2 |
1,042026 |
1,0381777 |
1,034819921 |
α |
0,981368 |
0,9834066 |
0,985164858 |
Обобщим результат:
При Т = 710К
![]() 0,9814
0,9814
При Т = 750К 0,9834
При Т = 790К 0,9852
Вывод:Т.к. α<1 то реакция будет идти в обратном направлении. Это значит, что тяжелый изотоп О18 будет накапливаться в жидкой фазе
