
- •Оглавление
- •1.Факторы, влияющие на растворимость газов.
- •2.Зависимость растворимости газа от температуры.
- •3.Факторы,влияющие на растворимость газов в жидкостях
- •4.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •5.Идеальные растворы. Построение их диаграммы «давление – состав», температура кипения – состав.
- •6.Вывод зависимости давления насыщенного пара смеси от состава жидкой и паровой фаз.
- •7. Реальные р-ры жидкостей неограниченно растворимые друг в друге. Причины отклонения давления паров над раствором от з-на Рауля.
- •8.Диаграммы давление –состав и температура – состав для реaльных растворов
- •9.Первый з-н Конавалова
- •10.Методы разделения смесей. Ректификация.
- •11. Диаграмма состояния р-ров ,образующих азеотропы.2й з-н Коновалова.
- •12.Диаграмма «давление – состав» и «температура – состав» Жидкости, ограниченно растворимых друг в друге.
- •13.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •14. Закон распределения Шилова-Нернста. Экстракция.
- •15. Трехкомпанентные системы. Графическое представление. Определение методами Розебома и Гиббса.
- •16.Диаграмма плавкости 2-х компонентных систем с огранич-ной растворимостью в твердом состоянии. Эвтектика.
- •17. Дифферинциальный термический анализ (дта)
- •18Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями.
- •19.Проводимость в газах, жидкостях и твердых телах. Электропроводность удельная и эквивалентная. Основные полож-я теории сильных эл-тов. Термодтнамика р-ров сильных эл-тов.
- •20. Скорость движ-ния иона,абсолютная ск-сть движ-я иона,подвижность.
- •21. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •23.Влияние различных факторов на электропроводность для р-ров сильных электролитов.
- •24.Уравнение Кольрауша для слабых и сильных электролитов. Числа переноса.
- •25. Ионная сила р-ра. Ионный радиус, ионная атмосфера. Электрофоретическое и релаксационное торможение. Эффект Вина,понятие дисперсии электропроводности.
- •26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
- •27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
- •28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
- •29. Термодинамика гальванических элементов.
- •30. Водородный скачок потенциала. Стандартные электродные потенциалы.
- •31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
- •32. Окислительно-восстановительные электроды или редокс-элементы.
- •33. Химические цепи. Уравнение для расчета эдс.
- •34. Концентрационные цепи. Уравнение для расчета эдс
- •35. Диффузионный скачок потенциала.
- •36. Потенциометрическое титрование. Электрохимические методы определения рН растворов.
- •37. Основные понятия химической кинетики: молекулярность, скорость реакции (начальная, истинная и средняя), константа скорости.
- •38. Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
- •39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
- •40. Вывод интегрального кинетического уравнения для необратимой и обратимой реакции первого порядка.
- •41. Вывод интегрального кинетического уравнения для необратимой реакции второго порядка.
- •42. Вывести уравнение кинетики для параллельных реакций.
- •43. Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
- •44. Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.
- •45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
- •46. Теория активных соударений и расчет скорости по числу соударений.
- •47. Теория переходного состояния и вывод основного уравнения.
- •48. Связь константы скорости реакции с энтальпией и энтропией активации.
- •49.Цепные р-ии, основные понятия, основные стадии и типы р-ий.
- •50.Кинетика р-ий с неразветвленными цепями.
- •51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
- •52.Пределы воспламенения и взрыва. Механизмы вопламенения.
- •53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
- •54. Законы и кинетика фотохимических р-ий. Примеры р-ий с различным квантовым выходом. Сенсибилизированные р-ии.
- •55.Особенности кинетики р-ий в р-рах. Влияние природы р-рителя на скорость процесса, ур-ие Бренстеда.
- •56. Влияние ионной силы и давления на кинетику реакций в растворе.
- •57.Основные признаки катализа.
- •58.Общий и специфич. Кислотно-основ.Катализ.
- •59.Катализ комплексами переходных металлов и ферментатив.Катализ.
- •60.Кинетика гомогенных катал. Р-ций
- •61. Гетерогенный катализ. Понятие о катализаторах, носителях и промоторах..
- •62.Области протекания гетероген.Катал.Р-ций.
- •63.Температурная зависимость наблюдаемой скорости реакции
- •66.Кинетика гетерогенных каталитических реакций, проводимых в реакторе идеального вытеснения.
- •68.Основные теории катализа: мультиплетная, ансамблей, электронная, радикальная.
- •69. Основные принципы твердых катализаторов.
- •70.Топохимические реакции.
38. Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
Рассмотрим термодинамический вывод выражения, описывающего зависимость константы скорости реакции от температуры и величины энергии активации – уравнения Аррениуса. Согласно уравнению изобары Вант-Гоффа,
![]() (II.31)
(II.31)
Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (II.31) следующим образом:
![]() (II.32)
(II.32)
Представив изменение энтальпии реакции ΔHº в виде разности двух величин E1 и E2, получаем:
![]() (II.33)
(II.33)
![]() (II.34)
(II.34)
Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации:
![]() (II.35)
(II.35)
После неопределенного интегрирования выражения (II.35) получим уравнение Аррениуса в интегральной форме:
![]() (II.36)
(II.36)
![]() (II.37)
(II.37)
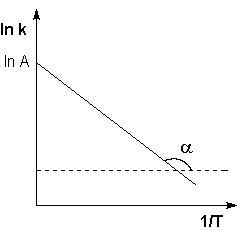
Рис. 2.7 Зависимость логарифма константы скорости химической
реакции от обратной температуры.
Здесь A – постоянная интегрирования. Из уравнения (II.37) нетрудно показать физический смысл предэкспоненциального множителя A, который равен константе скорости реакции при температуре, стремящейся к бесконечности. Как видно из выражения (II.36), логарифм константы скорости линейно зависит от обратной температуры (рис.2.7); величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).
![]() (II.38)
(II.38)
Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
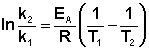
Энергия активации (E) – тот избыток энергии по сравнению со средней энергии молекул при данной температуре, которой должны обладать молекулы, чтобы они могли вступить в хим. реакцию. Если E↑, то υ↓
![]() ур-ние Аррениуса
ур-ние Аррениуса
графический:
![]()
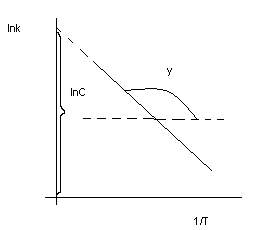
lnC – константа интегрирования
![]()
Отсюда определяем величину энергии активации.
по энергетическому барьеру:
и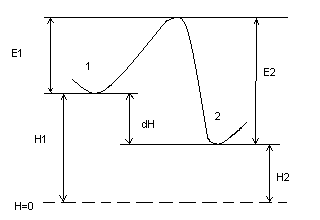 з
состояния 1 в состояние 2 при затрате
энергии Е1, обратный переход при
затрате энергии Е2
з
состояния 1 в состояние 2 при затрате
энергии Е1, обратный переход при
затрате энергии Е2
∆Н = Е2 - Е1
-∆Н = Н1 - Н2
Константа скорости не зависит от концентрации и зависит только от температуры. Эта зависимость называется законом Аррениуса (1889) и, в соответствии со вторым постулатом, имеет вид:
(1.5)
Здесь R – универсальная газовая постоянная и ko – предэкспоненциальный фактор, пропорциональный числу столкновений молекул с подходящей пространственной ориентацией, а множитель учитывает долю молекул, имеющих при столкновении энергию Е ≥ Ea (закон Больцмана).
39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
Для определения порядка реакции по реагенту известно несколько методов, которые излагаются ниже. В этом случае для точного определения порядка реакции по реагенту А все эксперименты проводятся при постоянной температуре и концентрации прочих реагентов (если имеются).
Наиболее просто можно определить порядок реакции из кинетической кривой СА(t), типа изображенной на рис. 1.
С C (0) С1 А С2 N M
|
Рис. 1. Изменение концентрации реагента во времени реакции: C(0), С1 и С2 начальная и текущая концентрация реагента в моменты t1 и t2
|
t1 t2 Время |
В различные моменты времени, при соответствующей концентрации определяют скорость реакции путем дифференцирования кривой (графически или аналитически), получая набор значений r(СА). Например, порядок реакции 1 по реагенту A можно найти из выражения:
log ri = log k. + а1.log CAi (1.19)
представленного в виде графика «lg
ri– lgCАi»,
причем тангенс угла наклона прямой в
этих координатах численно равен порядку
реакции mА. Найденный
из кинетической кривой порядок реакции
называют
![]() .
.
В методе Вант-Гоффа проводится серия экспериментов с различными начальными концентрациями реагента А, в которых определяется начальная скорость реакции, r0(С(0)А). Затем также строят график в координатах «lgr0–lgCА» и находят порядок реакции как тангенс угла наклона прямой в указанных координатах. Найденный таким образом порядок реакции называют концентрационным. Для элементарных реакций оба метода дают одинаковый результат; в случае сложных реакций получаются различные значения временного и концентрационного порядка реакции.
lg r0
--------
|
Рис. 7. Определение порядка реакции по экспериментальным данным: tg = mА |
Например, для газофазной реакции: Н2 + Br2 2 НBr концентрационный порядок по брому равен 0,5, а временной порядок по мере расхода брома увеличивается от 0,5 до 1,5 (при завершении реакции в замкнутой системе).
Можно определить порядок реакции по зависимости времени полупревращения от начальной концентрации реагента. Ниже будет показано, что для элементарных реакций эти величины взаимосвязаны (см. таблицу кинетических уравнений).
Порядок реакции можно найти, анализируя применимость соответствующих кинетических уравнений для описания кривых С(t) в линеаризующих координатах (см. ниже).
Для определения порядка реакции может быть полезным метод Оствальда- понижение порядка на единицу путем применения большого избытка одного из реагентов.
В стационарном состоянии системы можно использовать допущение о лимитирующей стадии, т.е. предположение о том, что скорость суммарного процесса определяется скоростью наиболее медленной стадии этого процесса, например, стадия 2 для схемы R9. Тогда скорость этой стадии равна:
r2 = k2 [B] = k2K1[A] (2.27)
в этом случае
b = K1 exp(-K1k2t) (2.28)
d = 1- (1+K1)exp(-K1k2t) (2.29)
Следует отметить (аналогия с гидравликой), что до лимитирующей стадии происходит накопление вещества, а после ЛС все концентрации промежуточных соединений весьма малы. При наличии ЛС вся кинетическая информация относится только к этой медленной стадии. В сложном многостадийном процессе при наличии ЛС всегда реализуется стационарный режим. Действительно, в таком случае концентрации реагентов изменяются со скоростью медленной ЛС, а концентрации промежуточных соединений практически равновесны.




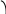
 lgC(0)A
lgC(0)A