
- •Оглавление
- •1.Факторы, влияющие на растворимость газов.
- •2.Зависимость растворимости газа от температуры.
- •3.Факторы,влияющие на растворимость газов в жидкостях
- •4.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •5.Идеальные растворы. Построение их диаграммы «давление – состав», температура кипения – состав.
- •6.Вывод зависимости давления насыщенного пара смеси от состава жидкой и паровой фаз.
- •7. Реальные р-ры жидкостей неограниченно растворимые друг в друге. Причины отклонения давления паров над раствором от з-на Рауля.
- •8.Диаграммы давление –состав и температура – состав для реaльных растворов
- •9.Первый з-н Конавалова
- •10.Методы разделения смесей. Ректификация.
- •11. Диаграмма состояния р-ров ,образующих азеотропы.2й з-н Коновалова.
- •12.Диаграмма «давление – состав» и «температура – состав» Жидкости, ограниченно растворимых друг в друге.
- •13.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •14. Закон распределения Шилова-Нернста. Экстракция.
- •15. Трехкомпанентные системы. Графическое представление. Определение методами Розебома и Гиббса.
- •16.Диаграмма плавкости 2-х компонентных систем с огранич-ной растворимостью в твердом состоянии. Эвтектика.
- •17. Дифферинциальный термический анализ (дта)
- •18Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями.
- •19.Проводимость в газах, жидкостях и твердых телах. Электропроводность удельная и эквивалентная. Основные полож-я теории сильных эл-тов. Термодтнамика р-ров сильных эл-тов.
- •20. Скорость движ-ния иона,абсолютная ск-сть движ-я иона,подвижность.
- •21. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •23.Влияние различных факторов на электропроводность для р-ров сильных электролитов.
- •24.Уравнение Кольрауша для слабых и сильных электролитов. Числа переноса.
- •25. Ионная сила р-ра. Ионный радиус, ионная атмосфера. Электрофоретическое и релаксационное торможение. Эффект Вина,понятие дисперсии электропроводности.
- •26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
- •27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
- •28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
- •29. Термодинамика гальванических элементов.
- •30. Водородный скачок потенциала. Стандартные электродные потенциалы.
- •31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
- •32. Окислительно-восстановительные электроды или редокс-элементы.
- •33. Химические цепи. Уравнение для расчета эдс.
- •34. Концентрационные цепи. Уравнение для расчета эдс
- •35. Диффузионный скачок потенциала.
- •36. Потенциометрическое титрование. Электрохимические методы определения рН растворов.
- •37. Основные понятия химической кинетики: молекулярность, скорость реакции (начальная, истинная и средняя), константа скорости.
- •38. Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
- •39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
- •40. Вывод интегрального кинетического уравнения для необратимой и обратимой реакции первого порядка.
- •41. Вывод интегрального кинетического уравнения для необратимой реакции второго порядка.
- •42. Вывести уравнение кинетики для параллельных реакций.
- •43. Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
- •44. Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.
- •45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
- •46. Теория активных соударений и расчет скорости по числу соударений.
- •47. Теория переходного состояния и вывод основного уравнения.
- •48. Связь константы скорости реакции с энтальпией и энтропией активации.
- •49.Цепные р-ии, основные понятия, основные стадии и типы р-ий.
- •50.Кинетика р-ий с неразветвленными цепями.
- •51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
- •52.Пределы воспламенения и взрыва. Механизмы вопламенения.
- •53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
- •54. Законы и кинетика фотохимических р-ий. Примеры р-ий с различным квантовым выходом. Сенсибилизированные р-ии.
- •55.Особенности кинетики р-ий в р-рах. Влияние природы р-рителя на скорость процесса, ур-ие Бренстеда.
- •56. Влияние ионной силы и давления на кинетику реакций в растворе.
- •57.Основные признаки катализа.
- •58.Общий и специфич. Кислотно-основ.Катализ.
- •59.Катализ комплексами переходных металлов и ферментатив.Катализ.
- •60.Кинетика гомогенных катал. Р-ций
- •61. Гетерогенный катализ. Понятие о катализаторах, носителях и промоторах..
- •62.Области протекания гетероген.Катал.Р-ций.
- •63.Температурная зависимость наблюдаемой скорости реакции
- •66.Кинетика гетерогенных каталитических реакций, проводимых в реакторе идеального вытеснения.
- •68.Основные теории катализа: мультиплетная, ансамблей, электронная, радикальная.
- •69. Основные принципы твердых катализаторов.
- •70.Топохимические реакции.
30. Водородный скачок потенциала. Стандартные электродные потенциалы.


31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
Гальванические элементы можно разделить на две группы:
а) химические гальванические элементы;
б) концентрационные гальванические элементы.
Химические гальванические элементы (например, гальванические элемент Даниэля - Якоби, Вестона) состоят из двух различных электродов, помещенных в растворы электролитов одинаковой концентрации. Для этих гальванических элементов характерно превращение энергии химической реакции в энергию электрического тока. К этой группе гальванических элементов принадлежит и гальванический элемент Вестона, используемый в качестве гальванического элемента - эталона.
Концентрационные гальванические элементы состоят из двух одинаковых электродов, помещенных в растворы различных концентраций. Опыт показывает, что электрод, погруженный в менее концентрированный раствор, является отрицательным электродом, а другой, погруженный в более концентрированный раствор - положительным.
Электроды первого рода. В
потенциалопределяющих реакциях на этих
электродах участвует один вид ионов.
Металлические электроды, обратимые
относительно катионов (в том числе и
амальгамные), и металлоидные, обратимые
относительно анионов:
![]() Уравнение
потенциалопределяющей реакции на
электродах, обратимых относительно
катионов,
Уравнение
потенциалопределяющей реакции на
электродах, обратимых относительно
катионов,
![]() Электродный
потенциал с учетом того, что активность
твердого вещества при данной температуре
постоянна и равна единице:
Электродный
потенциал с учетом того, что активность
твердого вещества при данной температуре
постоянна и равна единице:
![]() А
м а л ь г а м н ы е электроды состоят из
амальгамы металла, находящейся в контакте
с раствором, содержащим ионы этого
металла :
А
м а л ь г а м н ы е электроды состоят из
амальгамы металла, находящейся в контакте
с раствором, содержащим ионы этого
металла :
![]() Уравнения потенциалопределяющей
реакции электрода и его потенциала:
Уравнения потенциалопределяющей
реакции электрода и его потенциала:

 К электродам первого рода относятся
также газовые.
К электродам первого рода относятся
также газовые.
Водородный электрод пластинка из
платины, покрытая электролитической
платиновой чернью, погруженной в раствор,
содержащий потенциалопределяющие
вещества, через который пропускается
водород. В кислой среде системе
![]() отвечает уравнение потенциалопределяющей
реакции
отвечает уравнение потенциалопределяющей
реакции
![]() которое
может быть записано в упрощенном виде:
которое
может быть записано в упрощенном виде:
![]()
Потенциал водородного электрода
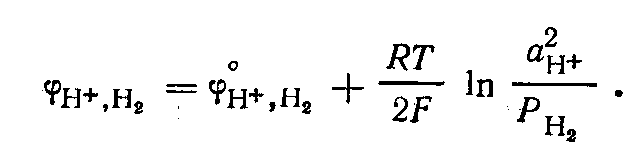
Поскольку стандартный потенциал
водородного электрода при всех
температурах условно принят равным
нулю, то при Р, = 1 потенциал
электрода определяется рН раствора:
![]() В
щелочной среде в системе
В
щелочной среде в системе
![]() протекает
потенциалопределяющая реакция по
уравнению
протекает
потенциалопределяющая реакция по
уравнению
![]() которому
отвечает уравнение для расчета потенциала:
которому
отвечает уравнение для расчета потенциала:
![]() Водородный
электрод применяется как индикаторный
при экспериментальном определении рН
растворов.
Кислородный электрод
по устройству аналогичен водородному
электроду. В щелочной среде для системы
Водородный
электрод применяется как индикаторный
при экспериментальном определении рН
растворов.
Кислородный электрод
по устройству аналогичен водородному
электроду. В щелочной среде для системы
![]() электродный
процесс и отвечающее ему уравнение для
расчета потенциала
электродный
процесс и отвечающее ему уравнение для
расчета потенциала
Создать практически кислородный электрод
с данной реакцией не удается, так как в
реальных условиях металлы под действием
кислорода окисляютсяэПотенциал
Кислородного электрода как в щелочной,
так и кислой среде зависит от рН
раствора:

Электроды второго рода.
Т![]() акие
электроды состоят из трех фаз:
металл
покрыт слоем его труднорастворимой
соли и погружен в раствор, содержащий
анионы, одноименные с анионами соли:
акие
электроды состоят из трех фаз:
металл
покрыт слоем его труднорастворимой
соли и погружен в раствор, содержащий
анионы, одноименные с анионами соли:
В потенциалопределяющей реакции на
этом электроде принимают участие как
катионы, так и анионы. Электрохимическому
процессу
![]() сопутствует
химическая реакция, приводящая к
осаждению или растворению МА:
сопутствует
химическая реакция, приводящая к
осаждению или растворению МА:
![]() Суммарное
уравнение реакции, согласно которой
электрод обратим относительно аниона,
Суммарное
уравнение реакции, согласно которой
электрод обратим относительно аниона,
![]() Последней
реакции соответствует уравнение для
расчета электродного потенциала
Последней
реакции соответствует уравнение для
расчета электродного потенциала

Электрод второго рода можно рассматривать
как электрод первого рода, обратимый
относительно катиона у которого
активтность в растворе определяется
растворимостью МА. Вследствие
устойчивости потенциалов электроды
второго рода могут быть использованы
как электроды сравнения при
потенциометрических измерениях. для
этого наиболее употребительны каломельный
и хлорсеребряный электроды.
Каломельный
электрод состоит из ртути, покрытой
пастой, содержащей каломель, и
соприкасающейся с раствором хлорида
калия:
![]() .
.
Уравнение потенциалопределяющей реакции
![]() По
концентрации применяемого раствора
КСI различают 0,1 н., 1 н. и насыщенный
каломельные электроды. Последний имеет
наиболее широкое применение. Хлорсеребряный
электрод серебряная пластинка,
покрытая АgС1 и погруженная
в раствор КСI. Уравнение электродной
реакции
По
концентрации применяемого раствора
КСI различают 0,1 н., 1 н. и насыщенный
каломельные электроды. Последний имеет
наиболее широкое применение. Хлорсеребряный
электрод серебряная пластинка,
покрытая АgС1 и погруженная
в раствор КСI. Уравнение электродной
реакции
![]()
Обратимыми элементами являются такие,в которых при зарядке и разрядке протекают одни и те же реакции,только в разных направлениях.
Zn + Cu2+ = Cu +Zn2+ (в элементе Даниэля-Якоби при разрядке)
При пропускании через элемент тока от внешнего источника,отличающегося на очень малую величину от тока разрядки:
Zn2+ + Cu= Cu2+ +Zn (при зарядке элемента)
Если в элементе Даниэля-Якоби в цинковом полуэлементе заменить раствор сульфата цинка на сульфат меди, то обратимый электрод превращается в необратимый.
В полуэлементах идут след. процессы:
В цинковом Cu2+ + 2e = Cu
В медном Cu – 2e = Cu2+
Знаки ЭДС элементов.
Для расчета ЭДС цепи необходимо складывать скачки потенциалов так,чтобы учитывался знак электродов. Общая ЭДС должна получаться с положительным знаком. В символической записи полуэлементы нужно располагать так,чтобы они отражали направление самопроизвольного протекания хим. Реакции в элементе. (убыль энергии Гиббса)
Вычисление ЭДС обратимого ГЭ
В электрохимических системах происходит
взаимное превращение энергии химических
реакций в электрическую энергию и
обратно. Применение законов термодинамики
к электрохимическим системам позволяет
рассчитать значения равновесных
электродных потенциалов и э. д. с.
электрохимических цепей. Для обратимой
реакции
![]() протекающей
при постоянных давлении и температуре
в электрохимической цепи, максимальная
полезная работа выражается уравнением
протекающей
при постоянных давлении и температуре
в электрохимической цепи, максимальная
полезная работа выражается уравнением
![]() ,
где Е- эдс элемента
,
где Е- эдс элемента
![]()
и соответствует электрической работе
при э. д. с. цепи Е, равной zFЕ.
Отсюда
 где
z— количество электронов,
участвующих в электродных реакциях
(одинаковое для обоих электродов); F
— число Фарадея.
Если активность
каждого участвующего в реакции вещества
равна 1, то э. д. с. цепи называется
стандартной и равна
где
z— количество электронов,
участвующих в электродных реакциях
(одинаковое для обоих электродов); F
— число Фарадея.
Если активность
каждого участвующего в реакции вещества
равна 1, то э. д. с. цепи называется
стандартной и равна
![]()
В соответствии с этим уравнение принимает вид
 Обозначив
Обозначив
![]() получаем
получаем
![]() Из
уравнения изотермы химической реакции
следует
Из
уравнения изотермы химической реакции
следует
![]() где
Ка — константа равновесия реакции (Ка
= К°). Отсюда
где
Ка — константа равновесия реакции (Ка
= К°). Отсюда
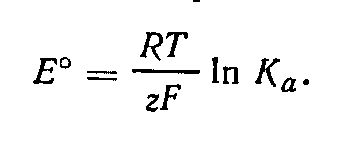 Связь
между э. д. с. электрохимической цепи и
изменением энтальпии протекающей в ней
реакции устанавливается на основании
уравнения Гельмгольца — Гиббса
Связь
между э. д. с. электрохимической цепи и
изменением энтальпии протекающей в ней
реакции устанавливается на основании
уравнения Гельмгольца — Гиббса

