
- •Пособие по химии
- •Поступающих в Военно-медицинскую академию
- •Предисловие
- •Раздел I. Общая химия
- •Глава 1. Основные понятия и законы химии
- •Обучающие задачи Моль. Молярная масса
- •Расчеты по химическим формулам. Массовая доля. Вывод формул соединений
- •Законы идеальных газов
- •Расчеты по химическим уравнениям
- •1) Из 80 г оксида меди образуется 64 г меди,
- •2) C 80 г оксида меди реагирует 1 моль водорода,
- •56 Г Fe (1 моль) выделяют 2 г h2
- •24 Г Mg (1 моль) выделяют 2 г h2
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 2. Строение атома. Периодический закон и периодическая система д.И. Менделеева
- •2.1. Строение атома
- •2) В случае равных сумм сначала заполняются орбитали с меньшим значением n.
- •2.2. Периодический закон и периодическая система элементов
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Глава 3. Химическая связь
- •3.1. Ковалентная связь
- •Обучающие задачи
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4.Водородная связь
- •Задания для самостоятельной работы
- •Глава 4. Валентность и степень окисления
- •4.1. Понятие валентности
- •4.2. Степень окисления
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 5. Классификация химических реакций
- •Задания для самостоятельной работы
- •Глава 6. Окислительно-восстановительные реакции
- •6.1. Основные понятия и определения
- •6.2. Методы составления уравнений окислительно-восстановительных реакций
- •6.3. Реакции электролиза
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 7. Растворы. Теория электролитической диссоциации
- •7.1. Основные понятия
- •7.2. Ионные уравнения реакций
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 8. Химическая кинетика
- •8.1. Понятие скорости химической реакции
- •8.2. Влияние концентрации на скорость реакции
- •8.3. Влияние температуры на скорость реакции
- •8.4. Энергия активации
- •8.5. Влияние катализатора на скорость реакции
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 9. Химическое равновесие
- •9.1. Понятие о химическом равновесии
- •9.2. Способы смещения химического равновесия
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 10. Классификация неорганических соединений
- •10.1. Оксиды
- •10.2. Гидроксиды
- •10.2.1. Основания
- •I. Получение щелочей.
- •10.2.2. Кислоты
- •10.2.3. Амфотерные гидроксиды
- •10.3. Соли
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел II. Неорганическая химия
- •Часть I. Химия металлов
- •Глава 11. Общая характеристика металлов
- •I. Взаимодействие с неметаллами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 12. Химия щелочных металлов
- •I. Взаимодействие с неметаллами.
- •II. Взаимодействие со сложными веществами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 13. Химия щелочноземельных металлов
- •13.1. Общая характеристика элементов главной подгруппы II группы
- •13.2. Кальций
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения кальция
- •Ca(oh)2 - гидроксид кальция(II), гашеная известь
- •Гидрид кальция CaH2 и карбид кальция СаС2
- •13.3. Жесткость воды и способы ее устранения
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 14. Химия алюминия Простое вещество
- •II. Взаимодействие cо сложными веществами.
- •Оксид алюминия Al2o3
- •Гидроксид алюминия Al(oh)3
- •Cоли алюминия
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 15. Химия железа Простое вещество
- •II. Взаимодействие со сложными веществами.
- •Соединения железа(II) Оксид железа(II)
- •Гидроксид железа(II)
- •Соединения железа(III) Оксид железа(III)
- •Гидроксид железа(III)
- •Cоли железа(III)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 16. Химия хрома и марганца
- •16.1. Хром
- •Простое вещество
- •Cоли хрома(III)
- •Соединения хрома(VI) Оксид хрома(VI), хромовый ангидрид
- •Кислоты и соли хрома(VI)
- •16.2. Марганец
- •Простое вещество
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 17. Химия меди и цинка
- •17.1. Медь
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения меди(I)
- •Соединения меди(II) Оксид меди(II)
- •Гидроксид меди(II)
- •Cоли меди(II)
- •17.2. Цинк
- •Простое вещество
- •Соединения цинка Оксид цинка ZnO
- •Гидроксид цинка Zn(oh)2
- •Соли цинка
- •Задания для самостоятельной работы
- •Ответы:
- •Часть II. Химия неметаллов
- •Глава 18. Химия водорода
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы:
- •Соединения водорода
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 19. Химия галогенов
- •19.1. Общая характеристика галогенов
- •Водородные соединения галогенов
- •19.2. Хлор
- •Хлороводород и соляная кислота
- •Кислородные кислоты хлора
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 20. Химия элементов подгруппы кислорода
- •20.1. Общая характеристика элементов подгруппы
- •Кислорода
- •20.2. Кислород
- •Простое вещество о2
- •I. Промышленные методы.
- •Простое вещество о3 (озон)
- •Соединения кислорода (с.О. 1) Пероксиды
- •Задания для самостоятельной работы
- •Ответы:
- •20.3. Вода
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •20.4. Сера
- •Простое вещество
- •Соединения серы Сероводород н2s
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Oксид серы(IV), cернистый газ
- •Сернистая кислота h2so3
- •I. Кислотные свойства.
- •II. Окислительно-восстановительные свойства.
- •Оксид серы(VI), cерный газ
- •Серная кислота
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 21. Химия элементов подгруппы азота
- •21.1. Общая характеристика элементов подгруппы азота
- •21.2. Азот
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы.
- •Соединения азота Аммиак
- •II. Лабораторные способы.
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли аммония
- •Оксиды азота
- •Азотистая кислота и ее соли
- •Азотная кислота
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли азотной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •21.3. Фосфор
- •Простое вещество
- •Фосфорные кислоты
- •I. В промышленности.
- •II. В лаборатории.
- •Соли ортофосфорной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 22. Химия элементов подгруппы углерода
- •22.1 Общая характеристика элементов подгруппы углерода
- •22.2. Углерод
- •Простое вещество
- •Неорганические соединения углерода с отрицательными степенями окисления (карбиды металлов)
- •Оксид углерода(II)
- •Оксид углерода(IV)
- •Угольная кислота
- •Соли угольной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •22.3. Кремний
- •Простое вещество
- •I. Промышленный способ:
- •II. Лабораторные способы:
- •Соединения кремния (с.О.4) Водородные соединения (силаны)
- •Оксид кремния(IV)
- •Кремниевые кислоты
- •Cоли кремниевых кислот (силикаты)
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел III. Органическая химия
- •Глава 23. Строение и номенклатура органических соединений
- •23.1 Теория строения органических соединений
- •23.2. Номенклатура органических соединений
- •Задания для самостоятельной подготовки
- •Глава 24. Химия углеводородов
- •24.1. Алканы
- •II. Лабораторные методы.
- •24.2. Циклоалканы
- •24.3. Алкены
- •24.4. Диеновые углеводороды
- •24.5. Алкины
- •24.6. Арены
- •I. Реакции электрофильного замещения.
- •III. Реакции окисления.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 25. Кислородсодержащие органические соединения
- •25.1. Спирты и фенолы
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.2. Альдегиды. Кетоны
- •I. Реакции присоединения.
- •II. Реакции полимеризации.
- •III. Реакция поликонденсации.
- •Задания для самостоятельной работы
- •Ответы:
- •25.3. Карбоновые кислоты
- •I. Кислотные свойства.
- •II. Реакции с разрывом связи со (замещение он-группы).
- •III. Реакции с разрывом сн связи у -углеродного атома.
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.4. Сложные эфиры. Жиры
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 26. Химия углеводов
- •26.1. Моносахариды
- •Глюкоза
- •Другие моносахариды
- •26.2. Дисахариды Мальтоза
- •Сахароза
- •26.3. Полисахариды Крахмал
- •Целлюлоза (клетчатка)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 27. Азотсодержащие органические соединения
- •27.1. Амины
- •27.2. Аминокислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 28. Гетероциклические соединения. Нуклеиновые кислоты
- •28.1. Гетероциклические соединения
- •Пиридин
- •28.3. Нуклеиновые кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •1. Таблица растворимости
Ответы:
4. 20.91 г C6H5NO2; 15.81 г C6H5NH2. 5. (С6H5NH2)= 0.46%. 6. C2H7N. 7. 30% С3Н8, 70% СН3NH2; 34.45 л О2. 8. (С6Н5ОН)= 18.8%; (C6H5NH2)= 25%. 9. 0.93 г C6H5NH2; 1.88 г С6Н5ОН; 7.19 г С6Н6. 10. 13.78 г CH3NH2; 51.6 г C6H5NH2. 11. 45 г/моль. 12. В избытке щелочь, m[CH2(NH2)COONa]=19.4 г. 13. [CH2(NH2)COOH]= 50.08%. 14. 13.35 г -аминопропионовой кислоты; 2.95 г амина состава C3H7NH2. 15. 8.9 г аланина.
Глава 28. Гетероциклические соединения. Нуклеиновые кислоты
28.1. Гетероциклические соединения
Гетероциклическими называют соединения, которые содержат циклы, состоящие не только из атомов углерода, но и атомов других элементов, чаще всего азота, кислорода, серы, которые называются гетероатомами.
Гетероциклические соединения могут классифицироваться:
1. По числу звеньев в цикле (трех-, четырехчленные и т.д.).
2. По характеру гетероатомов (кислород-, азот-, серусодержащие).
3. По количеству гетероатомов в цикле.
4. По степени насыщенности (предельные, непредельные, ароматические).
Пиррол
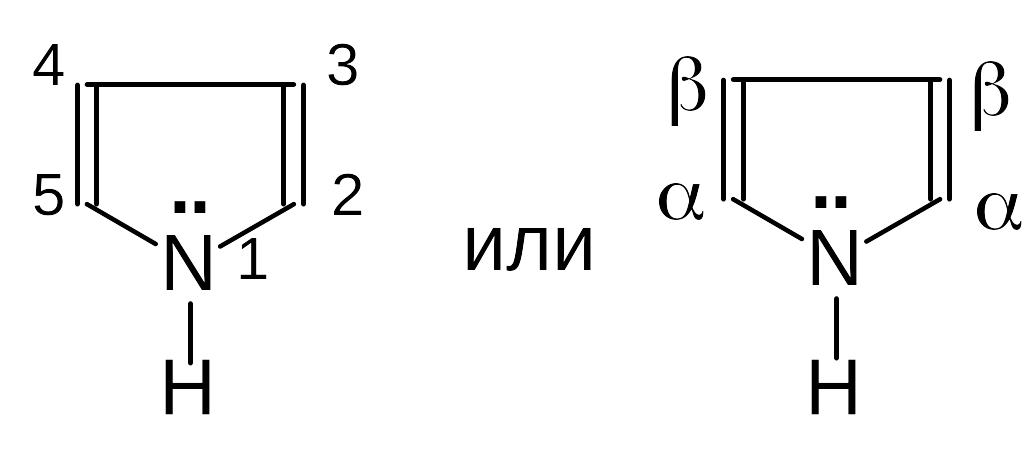
У пиррола неподеленная электронная пара азота образует с -электронами двойных связей общее облако, в результате чего пиррол является ароматическим циклом.
Пиррольный цикл входит в очень важные биологически активные вещества, такие как хлорофилл, гемоглобин, аминокислоты пролин и гидроксипролин.
Получают пиррол из каменноугольной смолы.
Химические свойства
1) Амфотерность.
а) Пиррол слабая кислота, так как свободная пара электронов азота участвует в образовании ароматической системы кольца, что ослабляет связь между азотом и водородом:
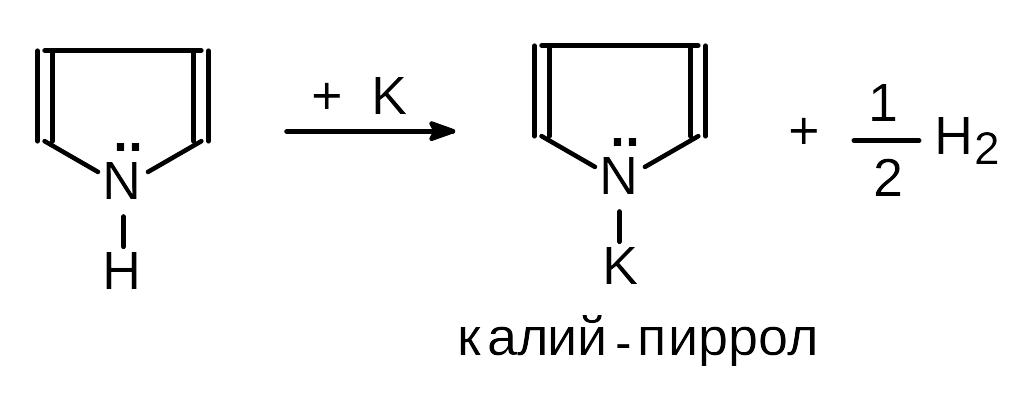
б) Пиррол очень слабое основание, к тому же, так как образование соли связано с нарушением ароматичности структуры, кислотные реагенты приводят к быстрой полимеризации продуктов реакции:

2) Гидрирование пиррола приводит к тетрагидропирролу (пирроли-дину) более сильному основанию по сравнению с пирролом:

3) Электрофильное замещение у пиррола под действием неразрушающих реагентов (кислоты, см. выше) происходит легче, чем в бензоле и протекает преимущественно в -положение кольца.
Пиридин

Пиридин также ароматичен, поскольку имеет 6-электронное облако.
Пиридиновый цикл входит во многие лекарственные препараты, такие как, например, витамин РР (никотинамид), витамин В6.
Получают пиридин из каменноугольной смолы.
Химические свойства
1) Кислотно-основные свойства.
Слабое основание, растворяется в воде.


2) Нуклеофильные свойства.
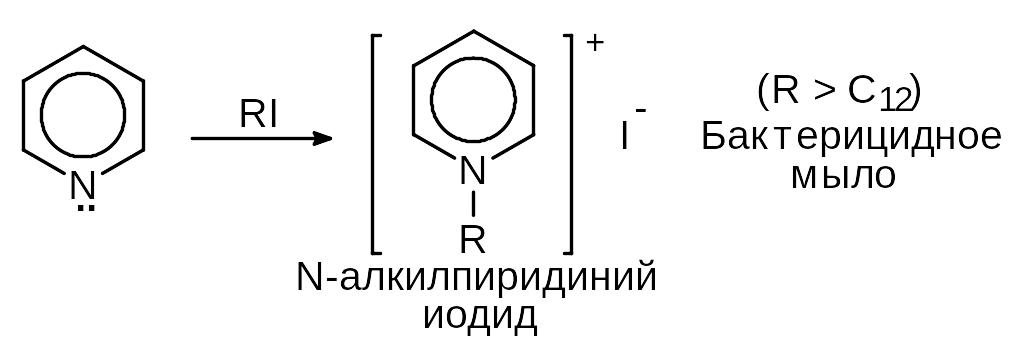
3) Реакции ароматического кольца.
а) Электрофильное замещение в пиридиновом кольце проходит в жестких условиях с замещением атома водорода при -углеродном атоме:

б) Реакции присоединения:

Пиримидин
Пиримидин азотистое основание, содержащее два атома азота в шестичленном ароматическом цикле.
Пиримидиновый цикл входит в состав нуклеиновых кислот, некоторых лекарственных препаратов, например, барбитуратов, витамина В1 и других.

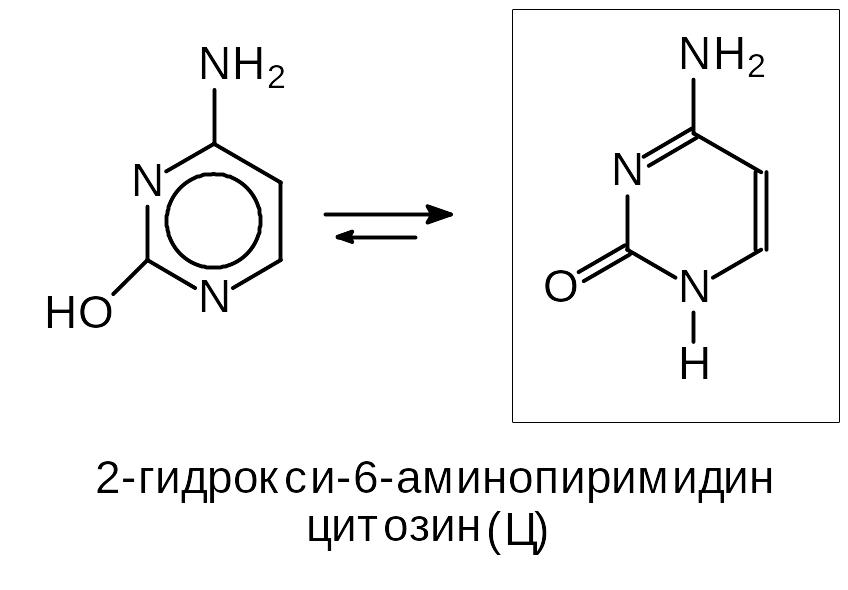
Пиримидиновые основания
Пиримидиновые основания производные пиримидина, входящие в состав биомолекул нуклеотидов.
Для этих соединений характерно равновесие, связанное с миграцией протона между атомами азота и кислорода.

Пурин
Пурин конденсированный ароматический гетероцикл, состоящий из пиримидина и имидазола пятичленного гетероцикла, содержащего также два атома азота. Пурин входит в состав нуклеиновых кислот, а также лекарственных препаратов.

Пуриновые основания
Пуриновые основания производные пурина. Аналогично пиримидиновым основаниям являются основой при построении нуклеотидов.

28.2. НУКЛЕОТИДЫ
Нуклеотиды сложные органические молекулы, образованные нуклеозидом продуктом взаимодействия азотистых (пуриновых и пиримидиновых) оснований с молекулой углевода и остатком ортофосфорной кислоты.
В качестве углевода при образовании нуклеозида выступают рибоза и дезоксирибоза, находящиеся в циклической -фуранозной форме.
Молекула сахара соединяется с азотистым основанием гидроксильной группой в первом положении (полуацетальным гидроксилом), азотистое основание атомом водорода в положении 9 (пуриновые) и 3 (пиримиди-новые основания).

Схема образования нуклеозида

В названиях пуриновых нуклеозидов появляется окончание -озин: аденозин, дезоксиаденозин или гуанозин. Названия пиримидиновых нуклеозидов заканчиваются на -идин: тимидин, цитидин или дезоксицитидин.
С остатком фосфорной кислоты нуклеозид соединяется через молекулу сахара посредством третьей или пятой гидроксильной групп:


Называют нуклеотиды двумя способами: либо как фосфат, либо как кислоту (см. схему).
Основным веществом, осуществляющим перенос энергии в биологических системах, является аденозин-5-трифосфат или аденозинтрифосфорная кислота (АТФ):

