
- •5 Коррозия меди и ее сплавов, способы их защиты.
- •16 Влияние температуры, рН, скорости течения жидкости на коррозионные процессы
- •17 Виды коррозии по поражению поверхности металлов и сплавов
- •18) Структурная и компонентная коррозия
- •19 Влияние электрохимического потенциала на коррозионное разрушение металлов и сплавов
- •20) Влияние концентрации соляных растворов на скорость коррозии
- •8 Жидкостная химическая коррозия металлов
19 Влияние электрохимического потенциала на коррозионное разрушение металлов и сплавов
|
Mg |
Al |
Zn |
Fe |
Sr |
H |
Cu |
Au |
ϕ(В) |
-1,53 |
-1,34 |
-0,76 |
-0,44 |
-0,1 |
0 |
0,34 |
1,32 |
активность уменьшается
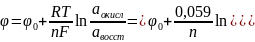
Примеси с более положительным электродным потенциалом, чем потенциал основы, будут ускорять электрохимическую коррозию, а примеси с более отрицательным электродным потенциалом - замедлять.
Впервые расписали теорию коррозионного процесса щвец. физик де ля Рив и совет. уч. Акинов. Они установили 3 причины: 1)неоднородность Ме 2)неоднородность окружающей среды 3)регулируемые параметры при эксплуатации.
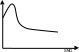
20) Влияние концентрации соляных растворов на скорость коррозии
Скорость электрохимической коррозии металлов в растворах солей зависит от природы соли и ее концентрации. Водные растворы гидролизующихся солей влияют на скорость коррозионного процесса увеличением рН раствора (например карбонат натрия) или уменьшением его (например хлорид аммония). Некоторые соли могут образовывать с первичным катодным или анодным продуктом коррозии металла пленку труднорастворимого соединения (например пленки фосфорнокислого железа на железе в растворах
фосфорнокислой соли), что приводит к снижению скорости коррозии. Растворы солей, обладающих окислительными свойствами, повышают скорость электрохимической коррозии металлов, если эти соли являются катодными деполяризаторами, но если они пассивируют металл, то скорость коррозии значительно снижается. Анионы ряда солей разрушают пленку, что приводит к повышению скорости коррозии. Если в растворе присутствуют хлориды или сульфаты, то скорость коррозии до некоторой концентрации соли в растворе возрастает, а затем постепенно уменьшается (рис.). При введении в воду небольших количеств хлоридов наблюдается увеличение скорости коррозии, что объясняется активирующим действием ионов хлора на анодный процесс. Последующее снижение коррозии стали объясняется уменьшением растворимости кислорода, являющегося катодным деполяризатором, с повышением концентрации соли в растворе.
8 Жидкостная химическая коррозия металлов
К неэлектролитам относят многие жидкие органические вещества (бензол, хлороформ и др.), жидкое топливо (нефть, керосин, бензин и др.), смазочные масла, а также жидкий бром, расплавленную серу и т.д.
В некоторых случаях на металлической поверхности из продуктов коррозии образуется защитная пленка, что приводит к торможению коррозионного процесса.
Температура
в значительной степени влияет на скорость
процессов химической коррозии металлов
в неэлектролитах. Характер этого влияния
определяется температурной зависимостью
константы скорости химической реакции
kc (при
кинетическом контроле процесса локисления
металла, или коэффициентом диффузии kD
(при
диффузионном контроле), которая выражается
уравнением Аррениуса:
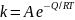 ,
где k –
константа скорости химической реакции
или коэффициент диффузии; А – постоянная;
Q – энергия активации химической реакции
или диффузии; R – газовая постоянная
(8,314 кДж/моль⋅К);
Т – абсолютная температура.
,
где k –
константа скорости химической реакции
или коэффициент диффузии; А – постоянная;
Q – энергия активации химической реакции
или диффузии; R – газовая постоянная
(8,314 кДж/моль⋅К);
Т – абсолютная температура.
Углеводороды и органические растворители, входящие в состав жидкого топлива, не коррозионноактивны по отношению к металлам, но различные примеси, которые присутствуют в достаточном количестве, вступают с металлами в химическое взаимодействие и разрушают их. Нефти высокую коррозионную активность придают растворенные в ней сернистые соединения: сероводород взаимодействует с Cu, Ag, Pb, Fe с образованием соответствующих сульфидов, меркаптаны (органические соединения типа R-S-H),
которые разрушают Pb, Cu, Ag, Co, Ni с образованием соответсвующих меркаптидов, а также элементарную серу, которая очень агрессивна по отношению к ………Ag и Cu.
Бензин прямой гонки при отсутствии воды практически не действует на технически важные металлы, а крекинг-бензин и сырые фенолы при взаимодействии со многими металлами (Fe, Pb, Mg, Cu, Zn) осмоляются, их кислотность повышается, что вызывает коррозию металлов.
