
- •1. Гранулометрический состав горных пород и методы его определения.
- •2. Седиментационный анализ механического состава горных пород.
- •3. Пористость горных пород. Коэффициент пористости.
- •4. Экстрагирование кернов. Принцип работы аппаратов Сокслета.
- •5. Определение коэффициента открытой пористости методом Преображенского.
- •26. Плотность природного газа и отдельных компонентов смеси.
- •6. Понятие насыщенности. Определение коэффициентов водо-, нефте- и газонасыщенности горных пород.
- •7. Проницаемость горных пород. Коэффициент абсолютной проницаемости.
- •8. Определение коэффициента абсолютной проницаемости по газу.
- •9 . Проницаемость горных пород. Явление проскальзывания газа.
- •8. Фазовые и относительные проницаемости горной породы.
- •9 . Графики относительных проницаемостей для системы «нефть-газ». Капиллярное число.
- •12. Движение смеси нефти, газа и воды в пористой среде.
- •13. Распределение пор по размерам. Функция Леверетта.
- •1 3. Зависимость проницаемости от пористости и размера пор.
- •14. Удельная поверхность горных пород. Связь с проницаемостью, пористостью и размером пор.
- •15. Деформационные свойства горных пород.
- •16. Деформация коллекторов при разработке нефтяных и газовых месторождений.
- •18. Поверхностное натяжение на границе раздела фаз. (17)
- •19. Смачивание и краевой угол смачивания.
- •22. Состав и классификация нефтей.
- •23. Состав и классификация природных газов.
- •24. Смеси газов. Мольная, массовая и объемная концентрации компонентов. Связь между ними.
- •25. Уравнение состояния реальных газов. Коэффициент сверхсжимаемости. (9,8)
- •38. Влагосодержание природных газов.
- •24. Закон соответственных состояний. Монограмма сверхсжимаемости.
- •26. Средняя молекулярная масса природного газа.
- •27. Парциальные давления и объём компонентов в смеси идеальных газов.
- •28. Упругость насыщенных паров.
- •29. Растворимость газов в нефти. Закон Генри.(11)
- •30. Плотность нефти. Зависимость от давления, температуры и состава.
- •34.Схема фазовых превращений бинарной смеси.
- •3 1. Вязкость нефти. Зависимость от давления, температуры и состава.
- •32. Структурно механические свойства аномальновязких нефтей.
- •33. Схема фазовых превращений индивидуальных компонентов углеводородов.(18)
- •35. Закон Рауля-Дальтона.
- •36. Особенности фазовых превращений газоконденсатных углеводородных систем.
- •36. Критическая температура и давление реальных углеводородных систем.
- •38. Уравнения фазовых концентраций и компонентов в смеси углеводородов.
32. Структурно механические свойства аномальновязких нефтей.
Реология - наука о течении как о деформации.
Обмен между слоями
движущейся жидкости количеством движения
приводит к торможению слоев, проявлявшемуся
как трение. Рассматривая течение как
деформацию реология в теоретическом
аспекте
выявляет связи и закономерности между
напряжением и скоростью деформации в
напрвлении нормали
к оси потока![]()
Касательное напряжение т, развивающееся в движущихся слоях ньютоновской жидкости, пропорционально градиенту скорости:
![]()
Величина![]() характеризует
деформацию слоев, следовательно
:
характеризует
деформацию слоев, следовательно
:![]() -
подобный тип записи называется
реологическим уравнением.
-
подобный тип записи называется
реологическим уравнением.
Для ньютоновских
систем![]()
Если в нефти содержатся асфальтены и смолы, то ее свойства могут существенно отличаться от свойств ньютоновской жидкости. Вязкость такой нефти зависит не только от давления и температуры, но и от скорости деформации, а также от состояния жидкости (от времени ее нахождения в покое).
Для описания поведения неньютоновских систем воапользоваться комбинациями простых механических моделей.
![]()
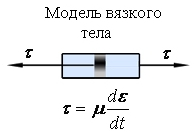

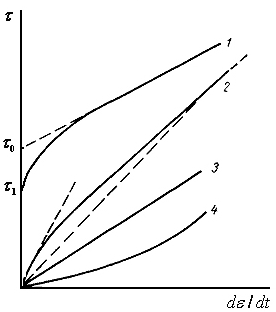
1 -
Бингамовский пластик![]()
В состоянии равновесия обладает пространственной структурой и способен сопротивляться сдвигающему напряжению, пока оно не превысит величину предельного напряжения сдвига.
2 - псевдопластик. Характеризуются отсутствием предела текучести, а также тем, что эффективная их вязкость понижается с увеличением скорости сдвига. Связано с ориентацией асимметричных молекул системы вдоль потока с возрастанием скорости сдвига.
3 - ньютоновская жидкость, вязкость системы не зави сит от скорости деформации.
4
- дилатантные жидкости
![]() относятся
к телам, у которых отсутствует предел
текучести, однако их эффективная вязкость
повышается с возрастанием
скорости сдвига. Такой тип течения
характерен для суспензий с большим
содержанием
твердой фазы.
относятся
к телам, у которых отсутствует предел
текучести, однако их эффективная вязкость
повышается с возрастанием
скорости сдвига. Такой тип течения
характерен для суспензий с большим
содержанием
твердой фазы.
где К—мера консистенции жидкости (с увеличением вязкости К возрастает); п< 1 — соответствует псевдопластикам; п > 1 — дилатантной жидкости.
33. Схема фазовых превращений индивидуальных компонентов углеводородов.(18)
Углеводородные газы, подобно всем индивидуальным веществам, изменяют свой объём при изменении давления и температуры. На рис. 3.1 представлена диаграмма фазового состояния для чистого этана. Каждая из кривых соответствует фазовым изменениям при постоянной температуре и имеет три участка. Слева от пунктирной линии отрезок соответствует газовой фазе, горизонтальный участок – двухфазной газожидкостной области, левый участок – жидкой фазе. Отрезок пунктирной линии вправо от максимума в точке С называется кривой точек конденсации (или точек росы), а влево от максимума – кривой точек парообразования (кипения). В точке С пунктирной линии кривые парообразования и конденсации сливаются. Эта точка называется критической.
С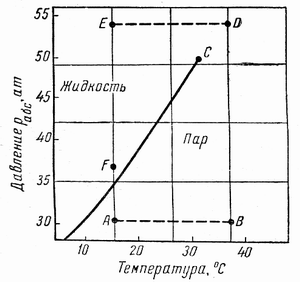 приближением температуры и давления к
критическим значениям свойства газовой
и жидкой фаз становятся одинаковыми,
поверхность раздела между ними исчезает,
и плотности их уравниваются. Следовательно,
с приближением к критической точке по
кривой начала кипения плотность жидкой
фазы будет непрерывно убывать. Если же
к ней приближаться по линии точек
конденсации, то плотность пара будет
непрерывно возрастать.
приближением температуры и давления к
критическим значениям свойства газовой
и жидкой фаз становятся одинаковыми,
поверхность раздела между ними исчезает,
и плотности их уравниваются. Следовательно,
с приближением к критической точке по
кривой начала кипения плотность жидкой
фазы будет непрерывно убывать. Если же
к ней приближаться по линии точек
конденсации, то плотность пара будет
непрерывно возрастать.
Для индивидуальных углеводородов граничным давлением между жидкой и газовой фазой является давление упругости паров (при данной температуре), при котором происходит конденсация или испарение. Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара над жидкостью. Давление при котором газ начинает конденсироваться называется давлением насыщения для газа.
Фазовые превращения углеводородов можно также представить в координатах давление-температура (рис. 3.2). Для однокомпонентной системы кривая давления насыщенного пара на графике давление-температура является одновременно кривой точек начала кипения и линией точек росы. При всех других давлениях и температурах вещество находится в однофазном состоянии.
Фазовая диаграмма индивидуальных углеводородов ограничивается критической точкой С (рис. 3.2). Для однокомпонентных систем эта точка определяется наивысшими значениями давления и температуры, при которых ещё могут существовать две фазы одновременно.
Из рисунка 3.2 следует, что путём соответствующих изменений давления и температуры углеводороды можно перевести из парообразного состояния в жидкое, минуя двухфазную область. Газ, характеризующийся параметрами точки А (рис. 3.2), можно изобарически нагреть до температуры точки В, а затем, повысив давление в системе при постоянной температуре, перевести вещество в область точки D, расположенную выше критической точки С, и далее в область точки Е. Свойства системы при этом изменяются непрерывно, и разделения углеводорода на фазы не произойдёт. При дальнейшем охлаждении системы (от точки D до точки Е), а затем при снижении давления до точки F вещество приобретёт свойства жидкости, минуя область двухфазного состояния.
