
- •1.Основные Законы геометрической оптики.
- •2.Тонкие сферические линзы. Формула тонкой линзы, построение изображений в линзах.
- •4.Дисперсия световых волн
- •6. Рассчитать интерференционную картину от 2-х источников.
- •7. Интерференция в тонких пленках
- •8.Использование интерференции
- •9. Дифракция света. Метод зон Френеля. Дифракция Френеля на круглом отверстии.
- •10. Дифракция Фраунгофера на щели. Условие максимума и минимума.
- •12.Поляризация света
- •13.Получение ПлоскоПоляризованного.
- •15. Анализ Поляризационного света. Закон Малюса.
- •16,Применение явлений поляризации
- •17. Тепловое излучение. Закон Кирхгофа.
- •18. Тепловое излучение. Закон Стефана-Больцмана. Законы Вина.
- •19. Излучение ачт – Смотрите 20
- •20. Излучение ачт гипотеза планка. Объяснение явления теплового излучения
- •21. Фотоэффект. Законы внешнего фотоэффекта.
- •4 Закона фотоэффекта
- •22. Квантовая теория фотоэффекта Уравнение Эйнштейна для фотоэффекта
- •23.Применение явления фотоэффекта
- •24. Эффект Комптона.
- •25. Квантовая теория давление света
- •26.Дискретностьфизических величин. Опыт франка герца
- •27. Дифракция электронов. Гипотеза Луи де Бройля.
- •30. Уравнение Шредингера.
- •31,Опыты Резерфорда классическая модель атома резенфорда
- •32. Постулаты Бора.
- •33. Квантовая теория атомаов. Квантовые числа. Принцип Паули.
27. Дифракция электронов. Гипотеза Луи де Бройля.
Он постулировал универсальность корпускулярно волнового дуализма, т.е. все положения дуализма могут быть применимы ко всем частицам материи.
Это означает для каждой частицы материи можно ввести поннятия:
E = h = hc/ сл-но можнл вычислит .
Импульс P = h/ = ħk; ħ – волновое число ħ = р/2; D = h/P = h/m0 - длинна волны де Бройля.
Экспериментальное подтверждение гипотезы Луи де Бройля.
В эксперименте по рассеянию электронов на кристаллах и по прохождению этих частиц через вещество; если электрон рассеивается на кристалле.
По де Бройлю частица обладает волновыми свойствами сл-но с этой частицей связываем плоскую монохроматическую волну.
(r,t)=Aexp(–I(t - kr)) – плоская монохроматическая волна.
Сделаем замену переменной в экспаненте и перейдем от к энергии, через = hc/ от k перейти к импульсу:
(r,t)=Aexp(-i/ħ (Et – pr)) – плоская волна де Бройля.
30. Уравнение Шредингера.
Квантовая механика способна объяснить поведение микрочастиц. Подобно тому, как законы Ньютона не выводятся, а является обобщением большого числа опытных фактов, так и уравнение Шредингера не выводятся. Оно постулируется. Шредингер записал уравнение, основываясь на экспериментальных результатах.
Состояние
микрочастиц в квантовой механике
описывается волновой функцией
 .
Она является функцией координат и
времени и может быть найдена из
уравнения Шредингера:
.
Она является функцией координат и
времени и может быть найдена из
уравнения Шредингера:
 .
.
Это
временное уравнение Шредингера для
случая, когда
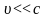 .
Здесь i
- мнимая единица (
.
Здесь i
- мнимая единица (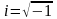 ),
),
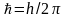 ,
m
- масса частицы,
,
m
- масса частицы,
 - оператор Лапласа (
- оператор Лапласа (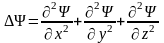 ),
),
 - потенциальная энергия частицы.
- потенциальная энергия частицы.
31,Опыты Резерфорда классическая модель атома резенфорда
С ущественную
роль в создании классической модели
атома (ядерной или планетарной) сыграли
опыты Резенфорда по рассеянию α-частиц.
α-частица представляет собой ядро атома
гелия (He),
образуется при распаде тяжелых элементов,
вылетает со скоростью v≈10(с.-7)м/с.
Резерфорд исследовал рассеяние α-частиц
на металлических фольгах. d=10(c.-4)см
– их толщина.
ущественную
роль в создании классической модели
атома (ядерной или планетарной) сыграли
опыты Резенфорда по рассеянию α-частиц.
α-частица представляет собой ядро атома
гелия (He),
образуется при распаде тяжелых элементов,
вылетает со скоростью v≈10(с.-7)м/с.
Резерфорд исследовал рассеяние α-частиц
на металлических фольгах. d=10(c.-4)см
– их толщина.
Подавляющее число α-частиц отклоняется на угол θ=π/2.
Очень незначительное число α-частиц изменили направление.
α-частица обладает массой и зарядом, т.е. на нее могут
действовать гравитационные и эл. силы. Т.к. гравитационные
силы незначительные, то отклонение α-частицы обусловлено действием на нее эл. поля со стороны зарядов внутри атомов. Можно расчитывать на какое расстояние должна приблизиться α-частица к заряду, чтоб под влиянием кулоновского поля этого заряда α-частица отбросилась назад.
m v(c.2)/2
– 2Lφ=2L*
(α/r),
r
≈10(c.-13)
см. => заряд, сосредоточенный в атоме,
имеет положительный знак и сосредоточен
в очень малом объеме. Из всех опытов
Резенфорд пришел к следующим представлениям
о строении атомоа. Внутри атома имеется
положительно заряженное ядро, заряд
которого +ze,
причем в ядре сосредоточен весь
положительный заряд атома. С ядром
связана и большая часть массы атома.
Заряд ядра совпадает с порядковым
номером элемента в таблице Менделеева.
Т.к. атом нейтрален, то в атоме кроме
положительно заряженного ядра есть
электроны, причем суммарный заряд
электронов равен положительному заряду
ядра. Положительно заряженное ядро и
электроны, входящие в состав атома,
определяют внутриатомное эл. поле,
которое в свою очередь характеризует
межатомные взаимодействия. Т.к. атом
является устойчивой системой, то
конфигурация электронов в атоме является
устойчивой. Однако никакое устойчивое
распределение зарядов не может быть
статическим. На основании этого Резенфорд
пришол к выводу, что электроны должны
вращаться вокруг ядра, подобно вращению
планет вокруг Солнца. В этом суть ядерной
или планетарной модели Резенфорда.
v(c.2)/2
– 2Lφ=2L*
(α/r),
r
≈10(c.-13)
см. => заряд, сосредоточенный в атоме,
имеет положительный знак и сосредоточен
в очень малом объеме. Из всех опытов
Резенфорд пришел к следующим представлениям
о строении атомоа. Внутри атома имеется
положительно заряженное ядро, заряд
которого +ze,
причем в ядре сосредоточен весь
положительный заряд атома. С ядром
связана и большая часть массы атома.
Заряд ядра совпадает с порядковым
номером элемента в таблице Менделеева.
Т.к. атом нейтрален, то в атоме кроме
положительно заряженного ядра есть
электроны, причем суммарный заряд
электронов равен положительному заряду
ядра. Положительно заряженное ядро и
электроны, входящие в состав атома,
определяют внутриатомное эл. поле,
которое в свою очередь характеризует
межатомные взаимодействия. Т.к. атом
является устойчивой системой, то
конфигурация электронов в атоме является
устойчивой. Однако никакое устойчивое
распределение зарядов не может быть
статическим. На основании этого Резенфорд
пришол к выводу, что электроны должны
вращаться вокруг ядра, подобно вращению
планет вокруг Солнца. В этом суть ядерной
или планетарной модели Резенфорда.
Модель Резенфорда явилась существенным шагом вперед,
т.к. представляла атом как динамическую систему
электрических зарядов. Для электронов, вращающихся
вокруг ядра, можно записать уравнение движения на
основе 2-го закона Ньютона: mv(c.2)/2=z*e*e/r (c.2) (1)
v – скорость электрона на орбите, r – радиус орбиты.
Однако модель Резенфорда явилась не универсальной. Недостатки: 1) уравнение (1) содержит 2 взаимосвязанных неизвестных v и r. Поэтому имеет. для них бесчисленное множество решений. Значит, что при изменении расстояния, а значит v и энергия электрона в атоме будут изменяться непрерывно. => атом Резенфорда будет непрерывно излучать. Опыт показывает, что в н.у. атом не излучает. 2) Т.к. атом Резенфорда излучает непрерывно, то спектр излучения атома должен быть сплошным. Опыт показывает, что спектры носят линейчатый харктер. 3) Согласно законам электродинамики электрон, вращаясь вокруг ядра, обладая нормальным ускорением, должен непрерывно излучать электро-магнитные волны => его энергия и расстояние м/у электроном и ядром должны непрерывно убывать. Т.к. из эксперимента известно, что атом излучает в течении τ=10(с.-8)с, то атом Резенфорда может существовать в течении этого времени, а после электрон упадет на ядро и атом прекратит свое существование. Эти недостатки имели принципиальное значени. Они показали, что движение электронов в атомах подчиняется иным законам, не нашедшим отражения в классической физике.
