
- •Основные законы и понятия химии.
- •Основные классы неорганических соединений.
- •Строение атома.
- •Периодическая система элементов.
- •Проявления периодического закона в отношении энергии ионизации
- •Проявления периодического закона в отношении энергии сродства к электрону
- •Проявления периодического закона в отношении электроотрицательности
- •Кристаллическое и аморфное состояние вещества.
- •Аморфные вещества
- •Кристаллические вещества
- •Типы кристаллических решеток
- •Химические системы.
- •Энтропия.
- •Гомогенные и гетерогенные системы.
- •Дисперсные системы.
- •Истинные растворы.
- •Электролитическая диссоциация в водных растворах.
- •Ионное произведение воды.
- •Сущность окислительно-восстановительных реакций.
- •Металлы.
Проявления периодического закона в отношении энергии ионизации
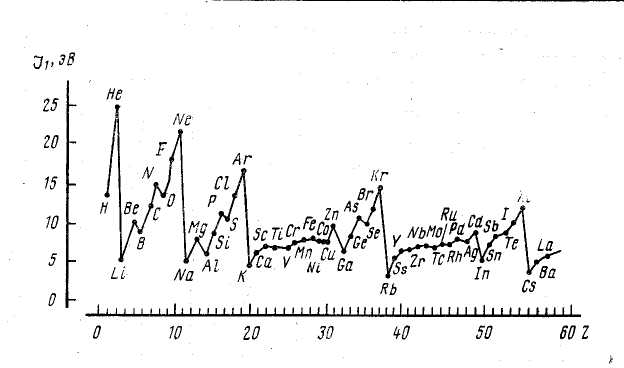
Рис. 1 Зависимость энергии ионизации атомов от порядкового номера элемента.
Зависимость энергии ионизации атома от порядкового номера элемента (рис. 1) носит отчетливо периодический характер. Легче всего удалить электрон из атомов щелочных металлов, включающих по одному валентному электрону, труднее всего — из атомов благородных газов, обладающих замкнутой электронной оболочкой. Поэтому периодичность изменения энергии ионизации атомов характеризуется минимумами, отвечающими щелочным металлам, и максимумами, приходящимися на благородные газы. Наряду с этими резко выраженными минимумами и максимумами на кривой энергии ионизации атомов наблюдаются слабо выраженные минимумы и максимумы, которые по-прежнему нетрудно объяснить с учетом упомянутых эффектов экранирования и проникновения, эффектов межэлектронных взаимодействий
Проявления периодического закона в отношении энергии сродства к электрону

Рис. 2 Зависимость сродства к электрону атома от атомного номера элемента (экзоэффект указан со знаком минус, эндоэффект со знаком плюс)
Периодичность значений энергий сродства атомов к электрону объясняется, естественно, теми же самыми факторами, которые уже были отмечены при обсуждении ионизационных потенциалов (см. определение энергии сродства к электрону).
Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s² (Be, Mg, Zn) и s²p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As)
Проявления периодического закона в отношении электроотрицательности
Рис. 3 Шкала электроотрицательности по
Полингу
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселенности, т. е. от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остается необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности, силовую постоянную и т. д.
Периодичность атомной электроотрицательности является важной составной частью периодического закона и легко может быть объяснена, исходя из непреложной, хотя и не совсем однозначной, зависимости значений электроотрицательности от соответствующих значений энергий ионизации и сродства к электрону.
В периодах наблюдается общая тенденция роста электроотрицательности, а в подгруппах — её падение. Наименьшая электроотрицательность у s-элементов I группы, наибольшая — у p-элементов VII группы.
Координаты ПСХЭ |
Ряд |
Количество |
Характеристика |
Связь со строением атомов |
Изменение в атоме |
Изменение свойств |
Периоды |
Горизонтальный |
7 |
1-3 - малые, 4-7 - большие |
Количество уровней в периоде одинаково. |
При движении слева на право увеличивается число электронов на последнем уровне |
Металлические свойства уменьшаются. Усиливаются окислительные свойства(принятие электронов)
|
Группа |
Вертикальный |
8 |
А - главная подгруппа, В - побочная подгруппа. |
На последнем уровне одинаковое количество электронов. |
При движении сверху вниз увеличивается количество уровней и радиус атома. |
Металлические свойства усиливаются. Усиливаются восстановительные свойства (отдача электронов) |
