
- •4. Формула мгновенной скорости.
- •6. Формула ускорения при криволинейном движении(по окружности)
- •7. Силы инерции
- •8. Силы инерции при криволинейном движении(по окруж)
- •Силовые поля
- •16. Определение консервативных сил
- •17. Доказать что работа консервативных сил на замкнутом пути равна 0
- •18. Физические поля(определение однородного поля)
- •19. Центральное поле силы(?!?)
- •22. Связь между потенциальной энергией и силой(формула с градиентом).
- •23. Полная механическая энергия
- •Полная механическая энергия: - характеризует движение и взаимодействие тел; и - является функцией скоростей и взаимного расположения тел.
- •24. Закон сохранения механической энергии для м.Т закон сохранения механической энергии
- •28. Момент инерции для тонкого однородного стержня(формула)
- •30. Кинетическая энергия вращения
- •31. Момент импульса.
- •32. Закон сохранения момента импульса. Закон сохранения момента импульса
- •33. Принцип относительности Галилея
- •34. Преобразование скоростей и ускорений .
- •35. Принцип относительности Эйнштейна
- •36.Принцип постоянства скорости света.
- •38.Следствия из преобразований Лоренца(время, длина)
- •39. Релятивистский закон сложения скоростей
- •42.Связь энергии с импульсом
- •43. Определение колебаний, их виды и характеристики
- •44. Математический,пружинный и физический маятники
- •45. Энергия гармонических колебаний
- •47. Вынужденные колебания
- •49. Упругие волны
- •51. Уравнение бегущей волны
- •52 Основные положения мкт: 3 основных положения молекулярно - кинетической теории:
- •1. Виды степеней свободы и число степеней свободы в идеальном газе
- •Формула
- •7.Явления переноса (диффузия, теплопроводность, вязкость)
- •8.Определение термодинамики и её параметров
- •9. Работа газов и изменение объемов
- •15. Работа при адиабатном процессе
- •16.Политропные процессы
- •18. Тепловая и холодильная машина
- •20. Цикл Карно и кпд идеального газа
- •21. Энтропия и её свойства
- •22 . Энтропия идеального газа
- •23 Статистический смысл 2-го начала термодинамики
- •24 Реальные газы
- •27. Экспериментальные изотермы реального газа
24 Реальные газы
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
![]()
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная.
25 Уравнение состояния газа Ван-дер-Ваальса —
уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, учитывающая силы межмолекулярного взаимодействия. В этой модели внутренняя энергия U становится функцией не только температуры, но и объёма. Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
![]()
где
p — давление,
V — молярный объём,
T — абсолютная температура,
R — универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
![]()
где
V — объём,
26. Изотермы Ван - Дер – Ваальса
Проанализируем изотермы уравнения Ван–дер–Ваальса – зависимости Р от V для реального газа при постоянной температуре. Умножив уравнение Ван-дер-Ваальса на V 2 и раскрыв скобки, получаем
PV 3 – (RT + bP) vV 2 + av2V - abv3 = 0.
Поскольку данное уравнение имеет третью степень относительно V, а коэффициенты при V действительны, то оно имеет либо один, либо три вещественных корня, т.е. изобара Р = const пересекает кривую Р = Р(V) в одной или трех точках, как это изображено на рисунке 7.4. Причем с повышением температуры мы перейдем от немонотонной зависимости Р = Р(V) к монотонной однозначной функции. Изотерма при Ткр, которая разделяет немонотонные T < Tкр и монотонные T > Ткр изотермы, соответствует изотерме при критической температуре. При температуре выше критической зависимость Р = Р(V) является однозначной монотонной функцией объема. Это означает, что при T > Ткр вещество находится только в одном, газообразном состоянии, как это имело место у идеального газа. При температуре газа ниже критической такая однозначность исчезает, а это означает возможность перехода вещества из газообразного в жидкое и наоборот. На участке АСВ изотермы Т1 давление растет с увеличением объема (dP/dV) > 0. Данное состояние неустойчиво, поскольку здесь должны усиливаться малейшие флуктуации плотности. Поэтому область ВСА не может устойчиво существовать. В областях DLB и AGE давление падает с увеличением объема (dP/dV)Т < 0 – это необходимое, но не достаточное условие устойчивого равновесия. Эксперимент показывает, что система переходит из области устойчивых состояний GE (газ) в область устойчивых состояний LD (жидкость) через двухфазное состояние (газ – жидкость) GL вдоль горизонтальной изотермы GCL.
При квазистатическом сжатии, начиная с точки G, система распадается на 2 фазы – жидкость и газ, причем плотности жидкости и газа остаются при сжатии неизменными и равными их значениям в точках L и G соответственно. При сжатии количество вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе – увеличивается, пока не будет достигнута точка L, в которой все вещество перейдет в жидкое состояние.
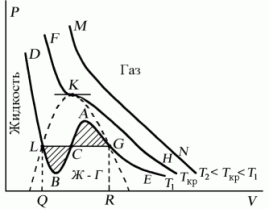 Рис.
7.4
Рис.
7.4
Наличие критической точки на изотерме Ван–дер–Ваальса означает, что для каждой жидкости существует такая температура, выше которой вещество может существовать только в газообразном состоянии. К этому заключению пришел и Д.И. Менделеев в 1861 г. Он заметил, что при определенной температуре прекращалось поднятие жидкости в капиллярах, т.е. поверхностное натяжение обращалось в нуль. При той же температуре обращалась в нуль скрытая теплота парообразования. Такую температуру Менделеев назвал температурой абсолютного кипения. Выше этой температуры, согласно Менделееву, газ не может быть сконденсирован в жидкость никаким увеличением давления.
Критическую точку K мы определили как точку перегиба критической изотермы, в которой касательная к изотерме горизонтальна (рис. 7.5). Ее можно определить также как точку, в которую в пределе переходят горизонтальные участки изотерм при повышении температуры до критической. На этом основан способ определения критических параметров Pk, Vk, Тk, принадлежащий Эндрюсу. Строится система изотерм при различных температурах. Предельная изотерма, у которой горизонтальный участок LG (рис. 7.4) переходит в точку, будет критической изотермой, а указанная точка – критической точкой (рис. 7.5).
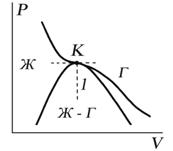 Рис.
7.5
Рис.
7.5
Недостаток способа Эндрюса заключается в его громоздкости.
