
- •4. Формула мгновенной скорости.
- •6. Формула ускорения при криволинейном движении(по окружности)
- •7. Силы инерции
- •8. Силы инерции при криволинейном движении(по окруж)
- •Силовые поля
- •16. Определение консервативных сил
- •17. Доказать что работа консервативных сил на замкнутом пути равна 0
- •18. Физические поля(определение однородного поля)
- •19. Центральное поле силы(?!?)
- •22. Связь между потенциальной энергией и силой(формула с градиентом).
- •23. Полная механическая энергия
- •Полная механическая энергия: - характеризует движение и взаимодействие тел; и - является функцией скоростей и взаимного расположения тел.
- •24. Закон сохранения механической энергии для м.Т закон сохранения механической энергии
- •28. Момент инерции для тонкого однородного стержня(формула)
- •30. Кинетическая энергия вращения
- •31. Момент импульса.
- •32. Закон сохранения момента импульса. Закон сохранения момента импульса
- •33. Принцип относительности Галилея
- •34. Преобразование скоростей и ускорений .
- •35. Принцип относительности Эйнштейна
- •36.Принцип постоянства скорости света.
- •38.Следствия из преобразований Лоренца(время, длина)
- •39. Релятивистский закон сложения скоростей
- •42.Связь энергии с импульсом
- •43. Определение колебаний, их виды и характеристики
- •44. Математический,пружинный и физический маятники
- •45. Энергия гармонических колебаний
- •47. Вынужденные колебания
- •49. Упругие волны
- •51. Уравнение бегущей волны
- •52 Основные положения мкт: 3 основных положения молекулярно - кинетической теории:
- •1. Виды степеней свободы и число степеней свободы в идеальном газе
- •Формула
- •7.Явления переноса (диффузия, теплопроводность, вязкость)
- •8.Определение термодинамики и её параметров
- •9. Работа газов и изменение объемов
- •15. Работа при адиабатном процессе
- •16.Политропные процессы
- •18. Тепловая и холодильная машина
- •20. Цикл Карно и кпд идеального газа
- •21. Энтропия и её свойства
- •22 . Энтропия идеального газа
- •23 Статистический смысл 2-го начала термодинамики
- •24 Реальные газы
- •27. Экспериментальные изотермы реального газа
20. Цикл Карно и кпд идеального газа
Теоремы Карно.
Все обратимые машины, работающие по циклу Карно, имеют, независимо от природы рабочего тела, одинаковый КПД при условии если у них общий нагреватель и холодильник.
Если две тепловые машины имеют общий нагреватель и холодильник и одна обратимая, а другая необратимая, то КПД обратимой больше необратимой
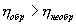
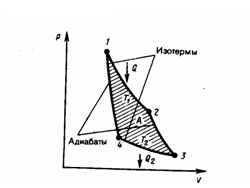 Рис.3
Рис.3
Цикл
Карно представлен на рис. 3, где
изотермические расширение и сжатие
заданы соответственно кривыми 1—2 и
3—4, а адиабатические расширение и сжатие
— кривыми 2—3 и 4—1. U=const при изотермическом
процессе, поэтому, используя формулы
термодинамики для изопроцессов,
количество теплоты Q1, полученное газом
от нагревателя, равно работе расширения
А12,
совершаемой газом при переходе из
состояния 1 в состояние 2:
![]() (1)
При адиабатическом расширении
2—3 теплообмен с окружающей средой
отсутствует и работа расширения А23
делается за счет изменения внутренней
энергии:
(1)
При адиабатическом расширении
2—3 теплообмен с окружающей средой
отсутствует и работа расширения А23
делается за счет изменения внутренней
энергии:
![]() Количество
теплоты Q2,
которое отдано газом холодильнику при
изотермическом сжатии, равно работе
сжатия А34:
Количество
теплоты Q2,
которое отдано газом холодильнику при
изотермическом сжатии, равно работе
сжатия А34:
![]() (2)
Работа адиабатического сжатия
(2)
Работа адиабатического сжатия
![]() Работа,
совершаемая в результате кругового
процесса,
Работа,
совершаемая в результате кругового
процесса,
21. Энтропия и её свойства
Энтропи́я (от греч. ἐντροπία — поворот, превращение) в естественных науках — мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния. Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]() ,
,
где dS — приращение энтропии; δQ — минимальная теплота, подведенная к системе; T — абсолютная температура процесса; свойства энтропии выглядят следующим образом. Энтропия есть параметр состояния, характеризующий свойства макроскопической системы в условиях равновесия. Энтропия системы может изменяться, но переходить из тела в тело она не в состоянии. Переходит только теплота. Таким образом, энтропия приобретает смысл удобного расчетного параметра, который получается, если количество тепла разделить на температуру. За сто лет в энтропии невозможно было обнаружить другого физического смысла.
По Клаузиусу, реальный (необратимый) процесс теплообмена между двумя телами происходит следующим образом. Первое тело теряет количество тепла. Это тепло приобретает второе тело. Вследствие теплообмена энтропия первого тела уменьшается на величину, а энтропия второго тела возрастает на величину. Знаменатель второй дроби меньше, чем знаменатель первой дроби, поэтому суммарное изменение энтропии двух тел всегда больше нуля.Отсюда видно, что необратимые взаимодействия сопровождаются возрастанием энтропии. Но на сколько увеличивается энтропия – этого вопроса теория Клаузиуса решить не в состоянии. В результате количественная сторона всех реальных процессов оказалась за семью замками. Максимум, что можно было сделать для реальных процессов в рамках идеи о переносе теплоты, это написать следующее знаменитое соотношение.
Знак равенства относится к идеальным процессам, а знак неравенства – к реальным. Теория Клаузиуса, сделавшая энтропию, как и всю термодинамику, принадлежностью равновесных состояний, завела науку в тупик, ибо лишила ее возможности изучать реальные (необратимые) процессы. 1. Обратимый процесс. В случае обратимого процесса
![]()
Интеграл по замкнутому контуру - это изменение энтропии во всем цикле, т.е. при обратимых циклах энтропия не меняется:
![]() 2.
Необратимый процесс.
2.
Необратимый процесс.
Исходя
из определения энтропии можем записать,
![]()
С
другой стороны для необратимого
процесса![]() Следовательно
Следовательно
![]() или
с учетом обратимого процесса
или
с учетом обратимого процесса![]()
|
(9.32) |
Таким образом, энтропия изолированной системы может только возрастать (если в системе протекают необратимые процессы), либо остается постоянной (если в системе протекает обратимый процесс). Убывать энтропия изолированной системы не может.
