
- •1. Тепловое излучение. Основные характеристики теплового излучения. Абсолютно черное тело. Закон Кирхгофа
- •2. Законы излучения абсолютно черного тела (Стефана – Больцмана и Вина). Гипотеза и формула Планка для абсолютно черного тела
- •3. Фотоны. Энергия, масса и импульс фотона
- •4. Внешний фотоэффект. Вольтамперная характеристика фотоэффекта. Законы Столетова. Уравнение Эйнштейна
- •5. Давление света
- •6. Комптон – эффект и его объяснение
- •7. Корпускулярно-волновой дуализм материи. Гипотеза де Бройля, ее экспериментальное подтверждение.
- •8. Волны де Бройля. Статистический смысл волн де Бройля, свойства волн.
- •9. Соотношения неопределенностей Гейзенберга, их физическое содержание
- •10. Статистический смысл и свойства волновой функции. Уравнение Шредингера в стационарной форме, смысл входящих величин
- •11. Частица в бесконечно глубокой одномерной потенциальной яме. Квантование энергии частицы. Собственные значения волновой функции
- •14. Туннельный эффект. Коэффициент прозрачности барьера
- •15. Квантово-механический осциллятор
- •16. Модель атома Бора. Постулаты Бора. Спектр излучения атома водорода. Недостатки теории Бора. Опыт Франка – Герца
- •17. Квантовомеханическая теория атома водорода. Уравнение Шредингера для атома водорода, анализ его решения. Собственные значения энергии электрона в атоме. Потенциал ионизации
- •18. Квантование энергии, момента импульса и проекции момента импульса электрона в атоме водорода
- •19. Кратность вырождения уровней энергий. Символика обозначения квантовых состояний
- •20. Магнитные свойства атома. Спин электрона. Орбитальные и спиновые характеристики электрона в атоме. Опыт Штерна – Герлаха
- •21. Полный набор квантовых чисел электронов в атоме, их физический смысл
- •22. Спектр излучения атома водорода. Правила отбора квантовых чисел. Серии излучения атома водорода
- •23. Символика обозначений квантовых состояний. Понятие о вырождении. Принцип Паули. Периодическая система Менделеева
- •26. Молекулы. Энергия молекул. Молекулярные спектры.
- •27. Физические принципы работы лазеров.
- •28. Твердое тело. Образование энергетических зон в твердом теле. Зона проводимости, валентная зона, запрещенная зона. Энергетическая схема твердого тела для металлов, полупроводников, диэлектриков.
- •29. Квантовая модель свободных электронов в металлах. Распределение электронов по энергиям. Уровень Ферми.
- •30. Функция Ферми – Дирака. Энергия Ферми. Понятие вырожденного и невырожденного электронного газа. Условие вырождения.
- •31. Плотность электронных состояний. Заполнение электронами энергетических зон. Энергия и уровень Ферми.
- •32. Элементы квантовой статистики. Нахождение числа электронов в заданном интервале энергий. Нахождение средних значений. Средняя энергия электронов в металле.
- •33. Электрическая проводимость твердых тел с точки зрения зонной теории. Металлы, полупроводники, диэлектрики.
- •34. Чистые полупроводники. Механизм проводимости. Зависимость проводимости от температуры.
- •35. Примесные полупроводники p-типа и n-типа. Механизмы проводимости. Зависимость проводимости от температуры.
- •36. Фотопроводимость полупроводников. Её закономерности.
- •37. Тепловые свойства твердых тел. Экспериментальная зависимость теплоёмкости твёрдых тел от температуры, её объяснение.
- •38. Теплоёмкость твердых тел. Закон Дюлонга – Пти, закон Дебая. Фононы.
- •40. Структура атомных ядер. Характеристики нуклонов. Символическая запись ядер.
- •45. Ядерные реакции, их закономерности. Реакции деления. Реакции синтеза. Энергетический выход реакции.
45. Ядерные реакции, их закономерности. Реакции деления. Реакции синтеза. Энергетический выход реакции.
Я́дерная реа́кция — процесс превращения атомных ядер, происходящий при их взаимодействии с элементарными частицами, гамма-квантами и друг с другом, часто приводящий к выделению колоссального количества энергии. При протекании ядерных реакций выполняются следующие законы: сохранения электрического заряда и числа нуклонов, сохранения энергии и
импульса, сохранения момента импульса, сохранения четности и
изотопического спина.
Реакция деления – деление атомного ядра на несколько более легких ядер. Деления бывают вынужденные и спонтанные.
Реакция синтеза – реакция слияния лёгких ядер в одно. Эта реакция происходит только при высоких температурах, порядка 108 К и называется термоядерной реакцией.
Энергетическим выходом реакции Q называется разность между суммарными энергиями покоя всех частиц до и после ядерной реакции. Если Q >0, то суммарная энергия покоя уменьшается в процессе ядерной реакции. Такие ядерные реакции называются экзоэнергетическими. Они могут протекать при сколь угодно малой начальной кинетической энергии частиц. Наоборот, при Q <0 часть исходной кинетической энергии частиц превращается в энергию покоя. Такие ядерные реакции называются эндоэнергетическими. Для их протекания необходимо, чтобы кинетическая энергия частиц превышала некоторую величину.
1. 1) Закон Стефана – Больцмана: Энергетическая светимость абсолютно черного тела пропорциональна четвертой степени абсолютной температуры: M0e = σT4, где σ = 5,67 · 10-8 Вт/(м2 · К4) – постоянная Стефана – Больцмана.
2) Закон смещения Вина: длина волны λ’, на которую приходится максимум излучения в спектре абсолютно черного тела, обратно пропорциональна абсолютной температуре: λ’ = b/T, где
b = 2,9 · 10-3 м·К.Теоретически излучение абсолютно черного тела было исследовано и рассчитано Планком в 1900 году, который впервые предположил, что энергия испускается в виде отдельных порций: постулат Планка. Постулат Планка: ε = hv, где
h = 6,626 · 10-34 Дж·с – постоянная Планка.
Формула Планка для расчета спектральной плотности энергетической светимости абсолютно черного тела имеет вид: Moλ,T = 2πhc2/λ5 · 1/exp(hc/λkT)-1, где c = 3·108 м/с – скорость света в вакууме, k = 1,38·10-23 Дж/К – постоянная Больцмана.
2. В нешним фотоэффектом называется явление испускания электронов веществом под действием света.
Зависимость тока от напряжения в цепи называется вольтамперной характеристикой фотоэлемента.
1) Количество фотоэлектронов N’e, вырываемых из катода за единицу времени, пропорционально интенсивности света, падающего на катод (закон Столетова). Или иначе: ток насыщения пропорционален мощности падающего на катод излучения: Ńф = P/εф .
2) Максимальная скорость Vmax, которую имеет электрон на выходе из катода, зависит только от частоты света ν и не зависит от его интенсивности.
3) Для каждого вещества существует граничная частота света ν0, ниже которой фотоэффект не наблюдается: v0 = Aвых/h. Уравнение Эйнштейна: ε = Aвых + mv2max/2, где ε = hv – энергия поглощенного фотона, Aвых – работа выхода электрона из вещества, mv2max/2 – максимальная кинетическая энергия вылетевшего электрона.
Уравнение Эйнштейна, по сути, представляет собой одну из форм записи закона сохранения энергии. Ток в фотоэлементе прекратится, если все вылетающие фотоэлектроны затормозятся, не долетев до анода. Для этого к фотоэлементу необходимо приложить обратное (задерживающее) напряжение u, величина которого также находится из закона сохранения энергии: |e|uз = mv2max/2.
3. Корпускулярно-волновой дуализм — это теория о том, что свет представляется на микроуровне одновременно и как мельчайшие частицы (корпускулы), и как волны. В частности, свет — это и корпускулы (фотоны), и электромагнитные волны.
В 1923 году французский ученый Луи де Бройль выдвинул гипотезу об универсальности корпускулярно-волнового дуализма. Он утверждал, что не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают также волновыми свойствами.
Согласно де Бройлю, с каждым микрообъектом связываются, с одной стороны, корпускулярные характеристики — энергия E и импульс p, а с другой стороны — волновые характеристики — частота и длина волны.
В 1948 году это удалось экспериментально подтвердить советскому физику В. А. Фабриканту. Он показал, что даже в случае столь слабого электронного пучка, когда каждый электрон проходит через прибор независимо от других, возникающая при длительной экспозиции дифракционная картина не отличается от дифракционных картин, получаемых при короткой экспозиции для потоков электронов в десятки миллионов раз более интенсивных.
4. Принцип неопределённости Гейзенберга - в квантовой механике так называют принцип, дающий нижний (ненулевой) предел для произведения дисперсий величин, характеризующих состояние системы.
Соотношения неопределённости Гейзенберга — это теоретический предел точности любых измерений. Они справедливы для так называемых идеальных измерений, иногда называемых измерениями фон Неймана. Они тем более справедливы для неидеальных измерений или измерений Ландау.
Соответственно, любая частица (в общем смысле, например несущая дискретный электрический заряд) не может быть описана одновременно как «классическая точечная частица» и как волна. (Сам факт того, что какое-либо из этих описаний может быть справедливо, по крайней мере в отдельных случаях, называют корпускулярно-волновым дуализмом). Принцип неопределённости, в виде, первоначально предложенном Гейзенбергом, верен в случае, когда ни одно из этих двух описаний не является полностью и исключительно подходящим, например частица в коробке с определённым значением энергии; то есть для систем, которые не характеризуются ни каким-либо определённым «положением» (какое-либо определённое значение расстояния от потенциальной стенки), ни каким-либо определённым значением импульса (включая его направление).
Соотношение неопределенности Гейзенберга показывает, что “между точностью, с которой одновременно может быть установлено положение частицы, и точностью ее импульса существует определенное соотношение”: q p ≥ h ,
где - среднеквадратичное отклонение.
5. Стационарное уравнение Шредингера для движения электрона в кулоновском поле ядра атома водорода и водородоподобных атомов имеет вид: ∆ψ + (8π2m/h2)(E-U)Ψ = 0,
где Ψ – волновая функция, ∆ - оператор Лапласа, Е – полная энергия электрона в атоме, U = -(Ze2/4πε0r) – потенциальная энергия.
6. Потенциальная яма – область пространства, где присутствует локальный минимум потенциальной энергии частицы.
Используя граничные условия, имеем:
Ψ(x = 0) = a sin α = 0 Отсюда, α = 0
Ψ(x = 1) = a sin ωl = 0 Отсюда, ωl = ± nπ (n = 1,2, …)
Учитывая значения ω, получим:
En = ħ2π2/2ml n2 (n = 1, 2, …)
En – собственные значения энергии.
Принцип квантования энергии гласит, что любая система взаимодействующих частиц, способная образовывать стабильное состояние - будь то кусок твердого тела, молекула, атом или атомное ядро, - может сделать это только при определенных значениях энергии.
7. Модель Бора выявила истинное значение спектральных законов и позволила установить, как эти законы отражают квантовый характер внутренней структуры атома - устойчивость структуры атома оказалась неразрывно связанной с существованием квантов. В модели Бора каждый атом обладает некоторой последовательностью квантовых (стационарных) состояний. Каждый вид атома имеет свою последовательность квантовых значений энергии, соответствующих различным возможным стационарным состояниям.
Постулаты Бора:
1) В атоме существует ряд дискретных стационарных состояний, которым соответствуют определенные значения энергии атома E1, E2 и т.д. В стационарном состоянии атом не излучает и не поглощает энергии.
2) Переходя из одного стационарного состояния в другое, атом излучает и поглощает квант энергии ε = hv, равный разности энергий En и En' двух стационарных состояний: hv = En' - En .
Атом водорода (Z = 1) имеет наиболее простой линейчатый спектр излучения. Частоты спектральных линий для атома водорода и водородоподобных атомов определяются по формуле: v = Rv(1/n2 – 1/n'2), где Rv = Z2me4/8ε02h3 = 3,29 · 1015 с-1 – постоянная Ридберга.
Также эта формула может быть записана через длину волны λ: 1/λ = Rλ(1/n2 – 1/n'2), где Rλ = 1,097 · 107 м-1.
Недостатки теории Бора:
- не смогла объяснить интенсивность спектральных линий.
- справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева.
- теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно - уравнение движения электрона - классическое, другое - уравнение квантования орбит - квантовое.
Опыт Франка - Герца - опыт, явившийся экспериментальным доказательством дискретности внутренней энергии атома.
В опыте наблюдался монотонный рост I при увеличении ускоряющего потенциала вплоть до 4,9 в, то есть электроны с энергией Е < 4,9 эв испытывали упругие соударения с атомами Hg и внутренняя энергия атомов не менялась. При значении V = 4,9 в (и кратных ему значениях 9,8 в, 14,7 в) появлялись резкие спады тока. Это определённым образом указывало на то, что при этих значениях V соударения электронов с атомами носят неупругий характер, т. е. энергия электронов достаточна для возбуждения атомов Hg. При кратных 4,9 эв значениях энергии электроны могут испытывать неупругие столкновения несколько раз.
Таким образом, опыт Франка - Герца показал, что спектр поглощаемой атомом энергии не непрерывен, а дискретен, минимальная порция (квант электромагнитного поля), которую может поглотить атом Hg, равна 4,9 эВ. Значение длины волны λ = 253,7 нм свечения паров Hg, возникавшее при V > 4,9 В, оказалось в соответствии со вторым постулатом Бора.
8. Уравнение Шредингера для атома водорода:
где ψ - волновая функция (аналог амплитуды для волнового движения в классической механике), которая характеризует движение электрона в пространстве как волнообразное возмущение; x, y, z - координаты, m - масса покоя электрона, h - постоянная Планка, E - полная энергия электрона, Ep - потенциальная энергия электрона.
Анализ решения уравнения Шредингера дает следующие результаты:
1. Электрон в атоме может иметь только определенные дискретные (квантованные) значения энергии, которые совпадают с выражением
E=-(Z2me4/8ε02h2n2),
где n – главное квантовое число.
2. Орбитальный момент импульса L электрона в атоме также может принимать лишь ряд дискретных значений
L=(h/2π)√l(l+1),
Где l – орбитальное квантовое число.
3. Проекция орбитального момента импульса Lz на выбранное направление OZ (например, направление внешнего магнитного поля) тоже квантуется
Lz=(h/2π)m,
где m – магнитное квантовое число.
Потенциал ионизации - разность электрических потенциалов, ускоряющая электрон до энергии, равной работе ионизации. Потенциал ионизации измеряется в вольтах и является индивидуальной характеристикой вещества. Различают: - первый потенциал ионизации, позволяющий оторвать один электрон от нейтрального невозбужденного атома; - второй потенциал ионизации, позволяющий оторвать два электрона; - третий потенциал ионизации, позволяющий оторвать два электрона и т.д.
Состояние электрона в атоме определяется набором четырех квантовых чисел, каждое из которых может принимать определенные значения:
Главное квантовое число: n = 1,2,3,…
Орбитальное квантовое число: l = 0,1,2,…,(n-1).
Магнитное квантовое число: m = 0,±1,±2,…,±l.
Спиновое квантовое число: ms = ±1/2
Физический смысл полного набора квантовых чисел электронов в атоме – порядковый номер электронного уровня, определение состояния электрона в атоме, описание электронных оболочек атомов. Каждый электрон в атоме имеет свой собственный «адрес», записанный набором четырех квантовых чисел
Для многоэлектронных атомов выполняется принцип запрета Паули: в одном и том же атоме не может быть двух электронов, обладающих одинаковым набором четырех квантовых чисел.
9. Образование энергетических зон в твердом теле можно представить следующим образом. Вначале предположим, что кристалл равномерно растянут так, что межатомные расстояния в нем очень велики. Тогда разрешенные уровни для электронов совпадут с атомными уровнями, которые для простоты будем предполагать невырожденными. В кристалле, состоящем из N атомов, каждый атомный уровень становится N-кратно вырожденным. Если затем начать постепенно уменьшать межатомные расстояния в кристалле, то вследствие растущего взаимодействия атомов друг с другом каждый уровень расщепится на серию N различных по энергии уровней. Вместо каждого N-кратно вырожденного уровня получаем зону энергий, содержащую N плотно размещенных уровней В случае глубоколежащих атомных уровней возмущение оказывается слабым по сравнению с силами взаимодействия между электроном и ядром; соответственно и расщепление этих уровней будет мало.
Зона проводимости — в зонной теории твёрдого тела первая из незаполненных электронами зон в полупроводниках и диэлектриках.
Валентная зона — энергетическая область разрешённых электронных состояний в твёрдом теле, заполненная валентными электронами.
Запрещённая зона — область значений энергии, которыми не может обладать электрон в идеальном (бездефектном) кристалле.
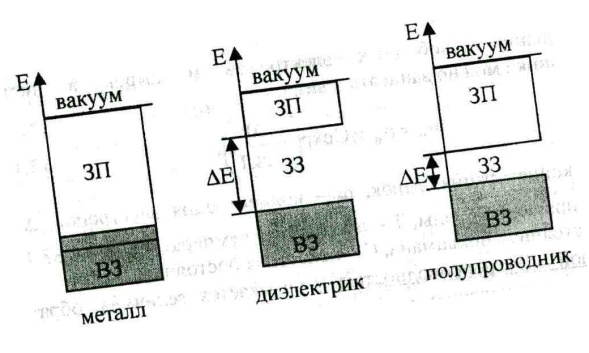
Уровень Ферми - уровень энергии, ниже которого все состояния при T = 0K заняты электронами
22. При температурах, T→0, полупроводник с правильной кристаллической решеткой не имеет свободных электронов в зоне проводимости и является хорошим изолятором.
При повышении температуры электроны получают тепловую энергию, которая даже при комнатных температурах может оказаться достаточной для перехода с верхних уровней валентной зоны в зону проводимости. В этом случае в валентной зоне освобождается свободное место, которое называется дыркой.
При наложении внешнего электрического поля на место дырки в валентной зоне может перейти электрон соседнего атома, т.е. дырка будет перемещаться в направлении, противоположном направлению электронов. Следовательно дырку можно рассматривать как фиктивный положительный заряд.
Таким образом, носителями заряда в чистых полупроводниках являются электроны в зоне проводимости и дырки в валентной зоне.
Электропроводность чистых полупроводников возрастает с увеличением температуры полупроводника.
Примеси могут быть донорного и акцепторного типа. Донор - это примесный атом или дефект кристаллической решётки, создающий в запрещенной зоне вблизи "дна" зоны проводимости энергетический уровень, занятый в невозбуждённом состоянии электроном и способный в возбуждённом состоянии при тепловом возбуждении отдать электрон в зону проводимости. Акцептор - это примесный атом или дефект кристаллической решётки, создающий в запрещённой зоне вблизи "потолка" валентной зоны энергетический уровень, свободный от электрона в невозбуждённом состоянии и способный захватить электрон из валентной зоны благодаря тепловому возбуждению.
Полупроводник n-типа получается, если в чистый полупроводник добавить примесь с валентностью, большей на единицу. Образуется один избыточный электрон. Для того, чтобы оторвать его от атома и превратить в свободный носитель заряда, требуется значительно меньшая, чем ширина запрещенной зоны, энергия. Полупроводник p-типа получается, если в чистый полупроводник добавить примесь с валентностью, меньшей на единицу. Т.е. образуется вакантное место – дырка. При повышении температуры на место этой дырки может перейти электрон соседнего атома. Для такого перехода требуется значительно меньшая, чем ширина запрещенной зоны, энергия.
В целом электропроводность полупроводника включает в себя собственную и примесную составляющие. При небольшом повышении температуры собственная проводимость полупроводника практически равна нулю, так как приобретенной электронами полупроводника тепловой энергии не хватает для преодоления запрещенной зоны. При повышении температуры (T≈350-400K) все атомы примеси полностью ионизируются и наступает примесное истощение.
12. Атомное ядро состоит из нуклонов — положительно заряженных протонов и нейтральных нейтронов, которые связаны между собой при помощи сильного взаимодействия. Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, часто называется нуклидом.
Нуклоны состоят из более простых частиц трех типов, названных кварками. Кварковая компонента нуклонов реализуется в виде двух возбуждённых барионных кластеров, испускающих главным образом нуклоны
Количество протонов в ядре называется его зарядовым числом Z — это число равно порядковому номеру элемента, к которому относится атом в таблице Менделеева. Количество нейтронов в ядре называется его изотопическим числом N. Полное количество нуклонов в ядре называется его массовым числом A (очевидно A = N + Z) и приблизительно равно средней массе атома, указанной в таблице Менделеева.
Ядерные силы – силы, удерживающие нуклоны в ядре. Ядерная сила – сила притяжения. Свойства ядерных сил:
1)Самое сильное из известных в природе взаимодействий.
2)Зарядовая независимость.
3)Ядерные силы – явление краткодействующее.
4)Обладает свойством насыщения.
5)Не являются центральными ядерными силами.
6)Вид нуклон - нуклонного потенциала.
Энергия связи ядра – энергия, которую необходимо затратить для расщепления ядра на отдельные нуклоны. Равна энергии всех нуклонов в свободном состоянии.
Дефект массы характеризует уменьшение суммарной массы при обозначении ядра из нуклонов: ∆M=Zmp+Nma-Ma=Eсв/c2.
Чем больше энергия связи, тем больше устойчивость ядра.
Для осуществления реакции между двумя или несколькими частицами необходимо, чтобы взаимодействующие частицы (ядра) сблизились на расстояние порядка 10−13 см, то есть характерного радиуса действия ядерных сил.
13. Радиоактивный распад – процесс превращения неустойчивых атомных ядер в ядра других элементов, который сопровождается испусканием частиц.
N=N0e-λt – закон радиоактивного распада, где N – число нераспавшихся ядер, N0 – число начальных ядер.
Физический смысл постоянной распада – вероятность распада ядра за единицу времени. Характерные времена жизни для радиоактивных ядер τ> 10-14 c. Времена жизни ядер, обусловленные испусканием нуклонов 10-23 с < <10-20 c. T1/2 – период полураспада – время, за которое распадается половина начального количества ядер. Активность радиоактивного источника – число распадов в единицу времени: A=λN.
Виды радиоактивного распада:
1)α – распад – сопровождается испусканием атомов гелия.
2)β – распад – испускание электронов и позитронов.
3)γ – распад – испускание фотонов при переходах между состояниями ядер.
4)Спонтанное деление ядер.
5)Нуклонная радиоактивность.
α – распад: A2X→A-YZ-2Y+42He. Α-распад наблюдается у тяжёлых ядер. Спектр α – распада дискретный. Длина пробега α – частицы в воздухе: 3-7см; для плотных веществ: 10-5м. T1/2 10-7с ÷ 1010лет.
