- •Ответы на вопросы химия
- •Экзо- и эндотермические реакции. Внутренняя энергия. Энтальпия. Стандартная энтальпия образования вещества. Тепловой эффект реакции
- •Вопрос 2. Закон Гесса и следствия из него. Применение закона для термохимических расчетов. Примеры
- •Следствия из закона Гесса
- •Вопрос 3. Понятие об энтропии. Изменение энтропии в самопроизвольно протекающих процессах. Стандартная энтропия вещества.
- •Вопрос 6. Применение закона действия масс для реакций, протекающих в несколько стадий. Лимитирующая стадия. Особенности кинетики гетерогенных процессов.
- •Вопрос 7 Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Энергия активации. Реакционная способность веществ. Уравнение Аррениуса
- •Вопрос 8 Влияние катализатора на скорость химических реакций. Гомогенный и гетерогенный катализ. Специфичность действия катализатора.
- •Вопрос 9 Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия, физический смысл. Связь константы равновесия с энергией Гиббса. Принцип Ле-Шателье.
- •Вопрос 10. Фазовые равновесия. Правило фаз Гиббса. Фазовые диаграммы для однокомпонентных систем.
- •Вопрос 12. Состояние электрона в атоме. Квантовые числа, их физический смысл, численные значения.
- •Вопрос 13 . Строение электронных оболочек многоэлектронных атомов. Принцип Паули. Правило Хунда. Правило Клечковского.
- •Вопрос 14. Периодический закон д.И. Менделеева. Структура Периодической системы с точки зрения строения атома. Период. Группа. Подгруппа. Физический смысл периодичности.
- •Вопрос 15. Свойства атомов. Радиусы атомов. Энергия ионизации. Сродство к электрону. Электроотрицательность.
- •Вопрос 16. Кислотно-основные и окислительно-восстановительные свойства соединений элементов и их изменение в Периодической системе элементов д.И. Менделеева.
- •Вопрос 24. Особенности реакций и равновесия в растворах электролитов. Произведение растворимости
- •Вопрос 19 Растворы электролитов. Теории кислот и оснований: теория электролитической диссоциации, протонная и электронная теории. Степень диссоциации. Сильные и слабые электролиты.
- •Вопрос 20. Факторы, влияющие на степень диссоциации электролитов. Определение степени диссоциации. Связь степени диссоциации с изотоническим коэффициентом.
- •Вопрос 21. Свойства слабых электролитов. Константа диссоциации. Закон разбавления Оствальда. Факторы, влияющие на равновесие диссоциации слабых электролитов.
- •Вопрос 22. Состояние сильных электролитов в растворе. Кажущаяся степень диссоциации. Активность. Коэффициент активности. Ионная сила раствора.
- •Вопрос 23 Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Кислотно-основные индикаторы.
- •Вопрос 25. Гидролиз солей. Степень гидролиза. Константа гидролиза. Факторы, влияющие на степень гидролиза. Примеры.
- •4.Гидролиз по катиону и аниону. Соли, образованные слабым основани-
- •Вопрос 28. Электролиз расплавов и растворов. Последовательность катодных и анодных процессов. Растворимый и нерастворимый аноды. Законы Фарадея.
- •Вопрос 29. Химическая и электрохимическая коррозия с кислородной и водородной деполяризацией. Основные методы защиты металлов от коррозии.
- •Вопрос 30. Общие свойства металлов. Классификация металлов. Способы получения металлов. Пирометаллургия. Гидрометаллургия. Электрометаллургия. Способы получения металлов высокой степени чистоты.
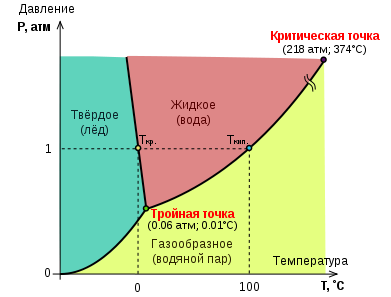
Вопрос 10. Фазовые равновесия. Правило фаз Гиббса. Фазовые диаграммы для однокомпонентных систем.
Фазовое равновесие - одновременное существование термодинамически равновесных фаз в многофазной системе.
Простейшие примеры – равновесие жидкости со своим насыщенным паром, равновесие воды и льда при температуре плавления, расслоение смеси воды с триэтиламином на два несмешивающихся слоя), отличающихся концентрациями.
При переходе в условиях равновесия частицы из одной фазы в другую энергия системы не меняется. Другими словами, при равновесии химические потенциалы каждой компоненты в различных фазах одинаковы. Отсюда следует правило фаз Гиббса: в веществе, состоящем из k компонент, одновременно могут существовать не более чем k + 2 равновесные фазы. Например, в однокомпонентном веществе число одновременно существующих фаз не превосходит трёх Число термодинамических степеней свободы, т. е. переменных (физических параметров), которые можно изменять, не нарушая условий Ф. р., равно k + 2 – φ, где φ – число фаз, находящихся в равновесии. Например, в двухкомпонентной системе три фазы могут находиться в равновесии при разных температурах, но давление и концентрации компонент полностью определяются температурой.
Изменение температуры фазового перехода (кипения, плавления и др.) при бесконечно малом изменении давления определяется Клапейрона – Клаузиуса уравнением, изображающие зависимость одних термодинамических переменных от других в условиях Фазового равновесия., называются линиями (поверхностями) равновесия, а их совокупность – диаграммами состояния Линия Фазового равновесия . может либо пересечься с другой линией равновесия (тройная точка), либо кончиться критической точкой
|
Однокомпонентной системой является любое простое в-во или хим. соед., обладающее строго определенным составом в газообразном, жидком и твердом состояниях. Диаграммы состояния обычно строят на плоскости в координатах Т-р 1). Фазовые поля пара V, жидкости L и твердой фазы S дивариантны, т.е. допускают одновременное изменение двух параметров состояния - Т и р. |
Вопрос 11. Современное представление о состоянии электрона в атоме. Двойственная природа микрообъектов. Уравнение Луи-де-Бройля. Принцип неопределенности Гейзенберга. Электронное облако. Атомная орбита ль. Физический смысл.
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона и пространстве, в котором он находится. Электрон в атоме не имеет траектории движения, то есть можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда
Электрон — частица, определяющая наиболее характерные химические свойства атомов и молекул. Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определенную массу покоя), а с другой - его движение напоминает волну и может быть описано определенной амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определенной траектории движения электрона - можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Под электронной орбитой следует понимать не определенную линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая.
В состоянии электрона есть какая-то неопределенность. В. Гейзенберг ввел понятие о принципе неопределенности, то есть показал, что, невозможно определить одновременно и точно энергию и местоположение электрона. Чем точнее определена энергия электрона, тем неопределеннее будет его положение, и наоборот, определив положение, нельзя определить энергию электрона. Область вероятности обнаружения электрона не имеет четких границ. Однако можно выделить пространство, где вероятность нахождения электрона будет максимальной. В нем заключено приблизительно 90% электронного облака, и это означает, что около 90% времени электрон находится в этой части пространства .
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. По форме различают 4 известных ныне типа орбиталей, которые обозначают латинскими буквами S,p,d,f.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра
Порядковый номер показывает коков заряд ядра, т. Кол-во протов., а также кол-во электронов. Номер периода показывает кол-во электронных слоев или энергетических уровней
Уравнение Луи-де-Бройля.( спросить)