
- •Ответы на вопросы химия
- •Экзо- и эндотермические реакции. Внутренняя энергия. Энтальпия. Стандартная энтальпия образования вещества. Тепловой эффект реакции
- •Вопрос 2. Закон Гесса и следствия из него. Применение закона для термохимических расчетов. Примеры
- •Следствия из закона Гесса
- •Вопрос 3. Понятие об энтропии. Изменение энтропии в самопроизвольно протекающих процессах. Стандартная энтропия вещества.
- •Вопрос 6. Применение закона действия масс для реакций, протекающих в несколько стадий. Лимитирующая стадия. Особенности кинетики гетерогенных процессов.
- •Вопрос 7 Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Энергия активации. Реакционная способность веществ. Уравнение Аррениуса
- •Вопрос 8 Влияние катализатора на скорость химических реакций. Гомогенный и гетерогенный катализ. Специфичность действия катализатора.
- •Вопрос 9 Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия, физический смысл. Связь константы равновесия с энергией Гиббса. Принцип Ле-Шателье.
- •Вопрос 10. Фазовые равновесия. Правило фаз Гиббса. Фазовые диаграммы для однокомпонентных систем.
- •Вопрос 12. Состояние электрона в атоме. Квантовые числа, их физический смысл, численные значения.
- •Вопрос 13 . Строение электронных оболочек многоэлектронных атомов. Принцип Паули. Правило Хунда. Правило Клечковского.
- •Вопрос 14. Периодический закон д.И. Менделеева. Структура Периодической системы с точки зрения строения атома. Период. Группа. Подгруппа. Физический смысл периодичности.
- •Вопрос 15. Свойства атомов. Радиусы атомов. Энергия ионизации. Сродство к электрону. Электроотрицательность.
- •Вопрос 16. Кислотно-основные и окислительно-восстановительные свойства соединений элементов и их изменение в Периодической системе элементов д.И. Менделеева.
- •Вопрос 24. Особенности реакций и равновесия в растворах электролитов. Произведение растворимости
- •Вопрос 19 Растворы электролитов. Теории кислот и оснований: теория электролитической диссоциации, протонная и электронная теории. Степень диссоциации. Сильные и слабые электролиты.
- •Вопрос 20. Факторы, влияющие на степень диссоциации электролитов. Определение степени диссоциации. Связь степени диссоциации с изотоническим коэффициентом.
- •Вопрос 21. Свойства слабых электролитов. Константа диссоциации. Закон разбавления Оствальда. Факторы, влияющие на равновесие диссоциации слабых электролитов.
- •Вопрос 22. Состояние сильных электролитов в растворе. Кажущаяся степень диссоциации. Активность. Коэффициент активности. Ионная сила раствора.
- •Вопрос 23 Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Кислотно-основные индикаторы.
- •Вопрос 25. Гидролиз солей. Степень гидролиза. Константа гидролиза. Факторы, влияющие на степень гидролиза. Примеры.
- •4.Гидролиз по катиону и аниону. Соли, образованные слабым основани-
- •Вопрос 28. Электролиз расплавов и растворов. Последовательность катодных и анодных процессов. Растворимый и нерастворимый аноды. Законы Фарадея.
- •Вопрос 29. Химическая и электрохимическая коррозия с кислородной и водородной деполяризацией. Основные методы защиты металлов от коррозии.
- •Вопрос 30. Общие свойства металлов. Классификация металлов. Способы получения металлов. Пирометаллургия. Гидрометаллургия. Электрометаллургия. Способы получения металлов высокой степени чистоты.
Вопрос 22. Состояние сильных электролитов в растворе. Кажущаяся степень диссоциации. Активность. Коэффициент активности. Ионная сила раствора.
Растворы электролитов, содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного в-ва.
В зависимости от состояния растворенного в-ва до растворения выделяют два класса р-ры ионофоров и р-ры ионогенов. Ионофоры в чистом состоянии существуют в виде ионных кристаллов . В сильнополярных р-рителях (напр., в воде) ионофоры, как правило, диссоциируют полностью и составляют р-ры сильных электролитов. В слабополярных р-рителях (напр., в уксусной к-те) они образуют р-ры слабых электролитов. Ионогены до растворения состоят из молекул, они являются потенц. электролитами,
Применительно к сильным электролитам используют понятие «кажущаяся степень диссоциации». Кажущаяся степень диссоциации в концентрированных растворах меньше единицы и увеличивается с уменьшением концентрации, стремясь к единице. Но в растворах сильных электролитов это связано с образованием из сольватированных ионов ассоциатов, которые ведут себя как недиссоциированные молекулы, т.е. не участвуют в переносе электричества и движутся как единое целое. Основное отличие ионных ассоциатов от недиссоциированных молекул в том, что в ассоциатах расстояние между сольватированными ионами значительно больше, чем в молекулах, т.к. между ионами находится растворитель. При уменьшении концентрации доля ассоциатов уменьшается, число частиц растворенного вещества увеличивается, и кажущаяся степень диссоциации растет. Активности определяют экспериментально. Активность, будучи подставлена в выражения законов для разбавленных растворов неэлектролитов, делает эти формулы применимыми для растворов электролитов. Аналитическая концентрация связана с активностью простым соотношением: а = γс,
где а – активность; с – аналитическая концентрация; γ – коэффициент активности.
Коэффициенты активности показывают меру отличия свойств реальных растворов от идеальных.
. Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
 ,
,
Вопрос 23 Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Кислотно-основные индикаторы.
Вода – слабый электролит – диссоциирует, образуя ионы Н+ и OH¯. Эти ионы гидратированы, т. е. соединены с несколькими молекулами воды, но для простоты их записывают в негидратированной форме
Н2O ↔ Н+ + OH¯.
На основании закона действия масс, для этого равновесия:
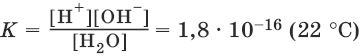
Концентрацию молекул воды [Н2O], т. е. число молей в 1 л воды, можно считать постоянной и равной [Н2O] = 1000 г/л : 18 г/моль = 55,6 моль/л. Отсюда:
К • [Н2O] = К(Н2O) = [Н+] • [OH¯] = 10-14 (22°C).
Ионное произведение воды – произведение концентраций [Н+] и [OH¯] – есть величина постоянная при постоянной температуре и равная 10-14 при 22°C.
Ионное произведение воды увеличивается с увеличением температуры.
Водоро́дный показа́тель, pH— мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логараф активности водородных ионов, выраженной в моля на литр: рН= -lg[H+]
Логарифмирование ионного произведения воды дает: рН + рOH = 14.
Величина рН характеризует реакцию среды.
Если рН = 7, то [Н+] = [OH¯] – нейтральная среда.
Если рН < 7, то [Н+] > [OH¯] – кислотная среда.
Если рН > 7, то [Н+] < [OH¯] – щелочная среда.
