
- •Ответы на вопросы химия
- •Экзо- и эндотермические реакции. Внутренняя энергия. Энтальпия. Стандартная энтальпия образования вещества. Тепловой эффект реакции
- •Вопрос 2. Закон Гесса и следствия из него. Применение закона для термохимических расчетов. Примеры
- •Следствия из закона Гесса
- •Вопрос 3. Понятие об энтропии. Изменение энтропии в самопроизвольно протекающих процессах. Стандартная энтропия вещества.
- •Вопрос 6. Применение закона действия масс для реакций, протекающих в несколько стадий. Лимитирующая стадия. Особенности кинетики гетерогенных процессов.
- •Вопрос 7 Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Энергия активации. Реакционная способность веществ. Уравнение Аррениуса
- •Вопрос 8 Влияние катализатора на скорость химических реакций. Гомогенный и гетерогенный катализ. Специфичность действия катализатора.
- •Вопрос 9 Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия, физический смысл. Связь константы равновесия с энергией Гиббса. Принцип Ле-Шателье.
- •Вопрос 10. Фазовые равновесия. Правило фаз Гиббса. Фазовые диаграммы для однокомпонентных систем.
- •Вопрос 12. Состояние электрона в атоме. Квантовые числа, их физический смысл, численные значения.
- •Вопрос 13 . Строение электронных оболочек многоэлектронных атомов. Принцип Паули. Правило Хунда. Правило Клечковского.
- •Вопрос 14. Периодический закон д.И. Менделеева. Структура Периодической системы с точки зрения строения атома. Период. Группа. Подгруппа. Физический смысл периодичности.
- •Вопрос 15. Свойства атомов. Радиусы атомов. Энергия ионизации. Сродство к электрону. Электроотрицательность.
- •Вопрос 16. Кислотно-основные и окислительно-восстановительные свойства соединений элементов и их изменение в Периодической системе элементов д.И. Менделеева.
- •Вопрос 24. Особенности реакций и равновесия в растворах электролитов. Произведение растворимости
- •Вопрос 19 Растворы электролитов. Теории кислот и оснований: теория электролитической диссоциации, протонная и электронная теории. Степень диссоциации. Сильные и слабые электролиты.
- •Вопрос 20. Факторы, влияющие на степень диссоциации электролитов. Определение степени диссоциации. Связь степени диссоциации с изотоническим коэффициентом.
- •Вопрос 21. Свойства слабых электролитов. Константа диссоциации. Закон разбавления Оствальда. Факторы, влияющие на равновесие диссоциации слабых электролитов.
- •Вопрос 22. Состояние сильных электролитов в растворе. Кажущаяся степень диссоциации. Активность. Коэффициент активности. Ионная сила раствора.
- •Вопрос 23 Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Кислотно-основные индикаторы.
- •Вопрос 25. Гидролиз солей. Степень гидролиза. Константа гидролиза. Факторы, влияющие на степень гидролиза. Примеры.
- •4.Гидролиз по катиону и аниону. Соли, образованные слабым основани-
- •Вопрос 28. Электролиз расплавов и растворов. Последовательность катодных и анодных процессов. Растворимый и нерастворимый аноды. Законы Фарадея.
- •Вопрос 29. Химическая и электрохимическая коррозия с кислородной и водородной деполяризацией. Основные методы защиты металлов от коррозии.
- •Вопрос 30. Общие свойства металлов. Классификация металлов. Способы получения металлов. Пирометаллургия. Гидрометаллургия. Электрометаллургия. Способы получения металлов высокой степени чистоты.
Вопрос 20. Факторы, влияющие на степень диссоциации электролитов. Определение степени диссоциации. Связь степени диссоциации с изотоническим коэффициентом.
Электролиты – вещества, которые подвергаются электролитической диссоциации, и вследствие чего их расплавы или растворы проводят электрический ток. К электролитам принадлежат все соли, а также кислотные, основные и амфотерные гидроксиды. Раствор электролита представляет собой смесь молекул растворителя и сольватированных (ионы растворенного вещества, окруженные соответственно ориентированными диполями растворителя) молекул и ионов растворенного вещества. Степень диссоциации а α = число молекул, распавшихся на ионы/ общее число растворенных молекул( выраженное в % )
Степень диссоциации электролитов зависит от концентрации растворов: с понижением концентрации уменьшается взаимодействие ионов в растворе, которое приводит к образованию молекул, поэтому степень диссоциации возрастает. По степени диссоциации электролиты принято делить на сильные, слабые и средние. Сильные электролиты имеют а > 30%; слабые - а < 3%; средние - а в пределах от 3 до 30%.
К сильным электролитам в водных растворах относятся почти все соли, большинство неорганических кислот (HNO3, HCl, H2SO4, HClO4 и др.), а также гидроксиды щелочных и щелочноземельных металлов.
Деление электролитов на слабые, средние и сильные носит условный характер, так как степень диссоциации зависит от природы электролита и растворителя, от концентрации и температуры раствора. Водные растворы различных солей, кислот и оснований одной и той же концентрации в разной степени диссоциируют на ионы. На степень диссоциации существенно влияет присутствие одноименных ионов в растворе.
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:
Через отношение реальной электропроводности к таковой при бесконечном разбавлении определяют мнимую степень диссоциации сильных электролитов, также обозначаемую через α:
![]() ,
,
где nimg — мнимое, а ndisslv. — реальное количество частиц в растворе.
Вопрос 21. Свойства слабых электролитов. Константа диссоциации. Закон разбавления Оствальда. Факторы, влияющие на равновесие диссоциации слабых электролитов.
Слабые электролиты вещества, частично диссоциирующие на ионы.
Растворы слабых электролитов наряду с ионами содержат недиссоциированионов в растворе.
Слабые электролиты плохо (или почти не проводят) электрический ток.
В растворах слабых электролитов диссоциация является обратимым процессом,
Важнейшей характеристикой слабого электролита служит константа диссоциации. КД, характеризует способность электролита распадаться на ионы. Чем больше значение константы диссоциации, тем сильнее электролит. Константа диссоциации зависит от природы электролита и температуры и не зависит от концентрации.
Рассмотрим равновесную реакцию диссоциации слабого электролита HAn:
НАn↔Н+ +Аn-
Константа
равновесия Kc
этой реакции и есть Kд:
![]() Если выразить равновесные концентрации
через концентрацию слабого электролита
C
и его степень диссоциации α, то получим
Если выразить равновесные концентрации
через концентрацию слабого электролита
C
и его степень диссоциации α, то получим
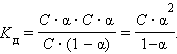
Связь между степенью диссоциации и константой выражается законом разбавления Оствальда α =√Кд/ С
Со – начальная молярная концентрация слабого электролита.
Влияние общего иона на диссоциацию слабого электролита: при добавление общего иона уменьшает диссоциацию слабого электролита. Так, при добавлении к раствору слабого электролита CH3COOH, например CH3COОNa и равновесие диссоциации CH3COOH сдвигается влево, т. е. диссоциация кислоты уменьшается.
