
- •1. Электродные процессы. Двойной электрический слой.
- •2. Гальванические элементы и цепи.
- •3. Электродные потенциалы. Водородный электрод. Ряд напряжений Ме.
- •4. Классификация электродов.
- •5.Стеклянный электрод.
- •6. Зависимость напряжений гэ от t - ры. Метод эдс.
- •9.Методы определения порядка реакции
- •13. Растворы электролитов. Теория электролитической диссоциации (I, a, Kg).
- •14. Сильные электролиты.
- •15. Механизм движения ионов. Абсолютная скорость ионов.
- •16(А). Удельная эл. Проводность р-ра.
- •16(Б). Эквивалентная проводность.
5.Стеклянный электрод.
Применяется для измерения активности иона водорода в различных средах. Он только относит. Н+ и явл-ся ионоселективным элект-м. Обратимость стеклянного электрода относит. Н+ обусловлена мембранным скачком потенциала.
R K |
K+Cl- K+Cl- |
1(+) 2(-)
Вследствие диффузии ионов в положении 1 созд. избыток положительного заряда, а в положении 2 – избыток отрицательного заряда. Т.к. созд. дефицит положит. заряда ёмкости 2, то возникает скачок потенциала, который препятствует перем-ию ионов К+ и способствует перемещению ионов Cl- , до установленного в системе равновесия при котором активности катионов и анионов в левой и правой части сравняются.
Строение стеклянного эл-да, хлорсеребряный электрод, помещён в стеклянную ёмкость с шариком. Шарик вып-ет функцию мембраны. Он наполнен жидкостью 0,1 и р-р. Толщина трубки 0,01 – 0,001 мм. На поверхности стекл. Шарика, который опускают в исследуемый раствор образуется плёнка гидротированного SiO2 .
Стекло / SiO32-, H+/H+ жел. р-р.
В гидротированной плёнке количество ионов Н+ является постоянным. Если в наружном слое измениться Сн+, то потенциал между наружным и внутренним слоем шарика будет являться ф-ией ионов Н+.
6. Зависимость напряжений гэ от t - ры. Метод эдс.
Из уравнения Нернста следует, что напряжен. ГЭ зависит от след. факторов:
1.от природы материала электрода (значение f0).
2.от активности или концентрации ионов р-ра электролита.
3.от температуры.
Е = Е0 + RT/ZF ln* aCu2+/aZn2+ - Ур-ие Нернста.
Метод ЭДС является экспериментальным мет-м определения напряжения ГЭ в зависимости от t-ры. Он позволяет установить взаимосвязь между Е ГЭ и термодинамическими харак-ми. DG,DS,DH.
Эта зав-ть определяется экспериментально. Метод позволяет определить взаимосвязь напряжения гальванического эл-та с термодинам-ми харак-ми:DG,DS,DH.
На основании ур-ия Гельш-Гольца:
DrG=DrH – T(jDG/jT)p (1)
DrG = -nFE = -ZFE
-ZFE=DrH–ZFT jE/jT
E= -DrH/ZF + jE/jT
DrH = ZF[jE/jT - E] (2)
jE/jT – темпер. Коэф., который находится из эксперимента зависимости E = f(T)
(jDG/jT)p = - DrS
DrS = ZF (jE/jT) (3)
DrG = - ZFE (4)
Формулы (2),(3),(4) определяют связь гальвонического элемента с термодинамическими характеристиками.
На основании величины стандартного напряжения Е0 можно определить const равновесия.
Из уравнения Фант-Гоффа (при стандартных условиях).
DrG = -RT lnKa = -ZFE0
E0 = RT/ZF lnKa (5).
9.Методы определения порядка реакции
1) Графический метод
Эксперимент устан-тся зависимость концентрации веществ от времени. После этого строится график.
I K = 1/r ln C0/C
lnC = lnC0 – Kr

II

2) По периоду полураспада.
r1/2 = A/C0n-1; A = const
lgr1/2 = lgA – (n - 1)lgC0
Строим график в координатах lgr1/2 и lgC0
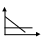
lga = n - 1
n – порядок реакции.
3) По начальным скоростям.
Хим. реакцию проводят при различных концентрациях какого-нибудь исходного вещества для того, чтобы концентрация других веществ не влияли на результаты их берут в значительном избытке.
А + В + С Д
СА<<СВ, СС
q1 = KС1n
q2 = KC2n
C1 – q1
C2 – q2
q1/q2 = C1n/C2n = (C1/C2)n
lg q1/q2 = n lg (C1/C2)
n = …

 Cl
Cl +Cl-
+Cl-