
- •Экзаменационный билет № 1
- •Общие представления о теориях строения дэс. Уравнение Пуассона-Больцмана для диффузной части дэс и его решение для случая слабозаряженных поверхностей. Уравнение Гуи-Чепмена.
- •Экзаменационный билет № 2
- •Механизмы образования дэс. Соотношение между электрическим потенциалом и поверхностным натяжением (уравнение Липпмана). Электрокапиллярные кривые и определение параметров дэс.
- •В таблице приведены данные по адсорбции паров воды макропористым адсорбентом при комнатой температуре. Пользуясь уравнением Ленгмюра определите емкость адсорбционного монослоя:
- •Экзаменационный билет № 3
- •Современная теория строения дэс (теория Штерна); роль специфической адсорбции, перезарядка поверхности. Примеры образования дэс. Строение мицеллы.
- •Адгезия и смачивание, определения. Уравнение Дюпре для работы адгезии. Угол смачивания и уравнение Юнга. Уравнение Дюпре-Юнга для работы адгезии. Влияние пав на адгезию и смачивание.
- •Экзаменационный билет № 5
- •Правило фаз Гиббса и дисперсность. Влияние кривизны поверхности (дисперсности) на внутреннее давление тел (вывод и анализ уравнения Лапласа). Капиллярные явления (уравнение Жюрена).
- •Вывод уравнения для скорости осаждения частиц в гравитационном поле. Условия соблюдения закона Стокса. Седиментационный анализ, расчет и назначение кривых распределения частиц по размерам.
- •Экзаменационный билет № 6
- •Экзаменационный билет № 7
- •Седиментационно-диффузионное равновесие (гипсометрический закон). Вывод уравнения. Мера седиментационной устойчивости. Факторы, влияющие на седиментационную устойчивость дисперсных систем.
- •Экзаменационный билет № 8
- •Экзаменационный билет № 9
- •Мономолекулярная адсорбция, форма изотермы адсорбции. Уравнение Генри. Основные положения теории Ленгмюра.
- •Лиофильные дисперсные системы. Классификация и общая характеристика пав. Термодинамика и механизм мицеллообразования. Строение мицелл пав в водных и углеводородных средах. Солюбилизация.
- •Экзаменационный билет № 10
- •Лиофильные дисперсные системы. Истинно растворимые и коллоидные пав, их классификация. Мицеллообразование, строение мицелл, методы определения ккм. Факторы, влияющие на ккм.
- •Экзаменационный билет № 11
- •Гидрозоль AgI получен добавлением 8 мл кi с концентрацией 0,05 моль/л к 10 мл раствора AgNo3 с концентрацией 0,02 моль/л. Напишите формулу мицеллы образовавшегося золя и объясните строение дэс.
- •Экзаменационный билет № 12
- •Экзаменационный билет № 13
- •Потенциальная теория адсорбции Поляни. Адсорбционный потенциал. Характеристическая кривая адсорбции. Температурная инвариантность и афинность характеристических кривых.
- •Экзаменационный билет № 14
- •Экзаменационный билет № 15
- •Экзаменационный билет № 16
- •Экзаменационный билет № 17
- •Ньютоновские жидкости, уравнения Ньютона и Пуазейля. Методы измерения вязкости. Уравнение Эйнштейна для вязкости дисперсных систем, границы применения.
- •Экзаменационный билет № 18
- •Седиментационный анализ. Кривые распределения частиц по размерам, их расчет и назначение, седиментация в центробежном поле.
- •Экзаменационный билет № 19
- •Правило фаз Гиббса и дисперсность. Влияние кривизны поверхности (дисперсности) на внутреннее давление тел (вывод и анализ уравнения Лапласа). Капиллярные явления (уравнение Жюрена).
- •Экзаменационный билет № 20
- •Седиментационно-диффузионное равновесие (гипсометрический закон). Вывод уравнения. Мера седиментационной устойчивости. Факторы, влияющие на седиментационную устойчивость дисперсных систем.
- •Рассчитайте разность уровней воды в двух сообщающихся капиллярах диаметрами 0,1 и 0,3 мм при 20 ºС. Поверхностное натяжение и плотность воды составляют соответственно 72,75 мДж/м2 и 0,998 г/см3.
- •Экзаменационный билет № 21
- •Мономолекулярная адсорбция, форма изотермы адсорбции, уравнение Генри. Основные положения теории Ленгмюра, вывод уравнения и его анализ, линейная форма уравнения Ленгмюра.
- •Строение двойного электрического слоя (дэс) по теории Штерна, перезарядка поверхности. Примеры образования дэс, строение мицеллы.
- •Экзаменационный билет № 22
- •Лиофильные дисперсные системы. Классификация и общая характеристика пав. Термодинамика и механизм мицеллообразования. Строение мицелл пав в водных и углеводородных средах. Солюбилизация.
- •Экзаменационный билет № 23
- •Рассчитайте работу адгезии и коэффициент растекания для системы вода-графит, если известно, что краевой угол равен 90 º, а поверхностное наятжение воды 72 мДж/м2.
- •Экзаменационный билет № 24
- •Лиофильные дисперсные системы. Истинно растворимые и коллоидные пав, их классификация. Мицеллообразование, строение мицелл, методы определения ккм. Факторы, влияющие на ккм.
- •Экзаменационный билет № 25
- •Потенциальная теория адсорбции Поляни. Десорбционный потенциал. Характеристическая кривая адсорбции. Температурная инвариантность и афинность характеристических кривых.
- •Экзаменационный билет № 26
- •Экзаменационный билет № 27
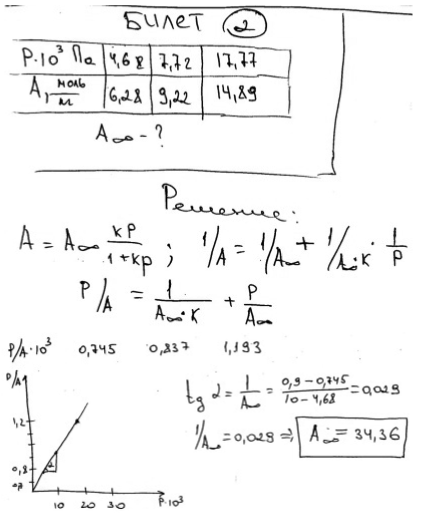
В таблице приведены данные по адсорбции паров воды макропористым адсорбентом при комнатой температуре. Пользуясь уравнением Ленгмюра определите емкость адсорбционного монослоя:
-
P·10-3, Па
А, моль/кг
4,68
6,28
7,72
9,22
17,77
14,89
Экзаменационный билет № 3
Метод избытков Гиббса. Вывод фундаментального адсорбционного уравнения Гиббса. Гиббсовская адсорбция. Частное выражение уравнения Гиббса. Поверхностная активность, поверхностно-активные и поверхностно-инактивные вещества.
Для описания термодинамики поверхностных явлений применяют два метода: метод избыточных величин Гиббса и метод «слоя конечной толщины».
Ч тобы
не определять границы поверхностного
слоя (поверхности разрыва по Гиббсу),
Гиббс предложил относить все изменения
термодинамических параметров в слое в
сравнении с параметрами объемной фазы
к разделяющей поверхности, не имеющей
объема или толщины (метод избыточных
величин Гиббса). При таком рассмотрении
поверхность характеризуется избыточными
термодинамическими параметрами,
непосредственно отражающими проявление
поверхностной энергии. Объемные фазы
считаются однородными вплоть до
разделяющей поверхности. В соответствии
с методом избыточных величин энергия
Гиббса системы равна сумме энергий
Гиббса G1
и G2
объемных фаз 1, 2 и поверхностной энергии
Гиббса σs,
которая является избыточной:
тобы
не определять границы поверхностного
слоя (поверхности разрыва по Гиббсу),
Гиббс предложил относить все изменения
термодинамических параметров в слое в
сравнении с параметрами объемной фазы
к разделяющей поверхности, не имеющей
объема или толщины (метод избыточных
величин Гиббса). При таком рассмотрении
поверхность характеризуется избыточными
термодинамическими параметрами,
непосредственно отражающими проявление
поверхностной энергии. Объемные фазы
считаются однородными вплоть до
разделяющей поверхности. В соответствии
с методом избыточных величин энергия
Гиббса системы равна сумме энергий
Гиббса G1
и G2
объемных фаз 1, 2 и поверхностной энергии
Гиббса σs,
которая является избыточной:![]()
Характеристика величины адсорбции определяющаяся избытком вещества в поверхностном слое определенной толщины по сравнению с его количеством в таком же объеме фазы, также отнесенным к единице площади поверхности или единице массы адсорбента, называется гиббсовской адсорбцией и обозначается буквой гамма Г (метод избыточных величин Гиббса).
Объединенное уравнение первого и второго начал термодинамики для внутренней энергии поверхности с учетом поверхностной и химической энергии имеет вид (объем поверхностного слоя равен нулю)
![]()
![]()
Так как внутренняя энергия поверхности пропорциональна экстенсивным величинам, то
и ее полный дифференциал от тех же переменных запишется следующим образом:
![]()
![]()
Подставляя значение dU, получим:
Д![]() ля
условия постоянства температуры это
соотношение принимает вид
ля
условия постоянства температуры это
соотношение принимает вид
![]()
Разделив полученное уравнение на площадь поверхности, получим:
Данное уравнение называют фундаментальным адсорбционным уравнением Гиббса.
Для адсорбции одного конкретного вещества при постоянных химических потенциалах других веществ полученное уравнение можно записать относительно частной производной для данного компонента:
![]()
Принимая во
внимание, что
![]()
Для гиббсовской адсорбции это выражение принимает вид
![]()
-
Для растворенного вещества это выражение переходит в широко используемые адсорбционные уравнения Гиббса для неэлектролитов
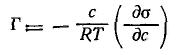
и для электролитов при их диссоциации в полярной фазе и отсутствии ее в поверхностном слое (при неполярной второй фазе):
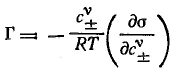
Общее определение поверхностной активности дается соотношением:
![]()
которое справедливо как для неэлектролитов, так и для электролитов.
Поверхностная
активность, как и гиббсовская адсорбция,
может быть положительной и отрицательной.
Абсолютное значение и ее знак зависят
от природы как адсорбируемого вещества,
так и среды (растворителя). Если с
увеличением концентрации вещества
поверхностное натяжение на границе
раздела фаз понижается, то такое вещество
называют поверхностно-активным. Для
таких веществ
![]()
Вещества, повышающие
поверхностное натяжение на границе
раздела фаз с увеличением концентрации,
называют поверхностно-инактивными. Для
них![]()
