
- •1.Первый закон терм-ки. Термод. Координаты, обобщенные силы.
- •2.Второй закон термодинамики. Общее понятие энтропии.
- •3.Основные условия существования термодинамического равновесия.
- •4.Химический потенциал.
- •5.Основные термодинамические потенциалы.
- •7.Термод. Потен-лы идеального газа.
- •8.Распределение в-ва м/у 2 фазами.
- •9.Фазовые превращения. Уравнения Клаузиуса – Клапейрона и Кирхгофа.
- •10.Хим. Равновесие в гом-ых сис-х.
- •11.Изменение свободной энергии при химических реакциях.
- •12. Изменение энергии Гиббса при изменении температуры.
- •15.Равновесие в гетеро-х системах.
9.Фазовые превращения. Уравнения Клаузиуса – Клапейрона и Кирхгофа.
Плавление, возгонка, аморфные превращения. Основ. хар-ка – тем-ра, кот-рая зависит от давления. Для нахождения связи м/у Т и р используем смешан-е произ-ные по переменным разных видов:

При фаз-х прев-ях р не зависит от V. Поэтому частные произ-е можно заменить полной.
При изотерм. фаз-х прев-х V меняется на ΔV, а энтропия на ΔS

Т.к. процесс фаз-го прев-я яв-ся изотермич. и равновесным, то

q – теплота плавления, затверд.,…
ΔV = V’’ – V’
Ур-е (3) - ур-е Клауз-са-Клапейрона
Если тем-ра значит. ниже критич. то V-ом жидкости и тв. тела можно пренебречь по сравнению с объемом пара



I – химич. постоянная
Поскольку фаз-й переход происх-т при постоянном давлении, то для нах-ния зависимости q(T) используют зав-ть энтальпии от тем-ры:
q = Нп – Нж


Cоот. (7) – ур-ние Кирхгофа
10.Хим. Равновесие в гом-ых сис-х.
Для решения подобных
задач необход. характер. равновесие и
найти параметры от которой зависит
равнов-е: CO+1/2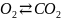
При относит-но низких t равн-е сдвинута влево, а при увеличении t происх-т диссоц-я.
Рассмотр. условие равнов-я газовых р-ций в общем случае: А+2В=3D. При условии пост-ых Р и Т свобод-я эн-я в равновесной системе имеет min знач-е. В рассм-ом случае

В против-ом случае
не было бы равнов-я. Учитываем, что для
идеал-го газа
 ;
;
3
где
 ,
,
 ,
, - парциальные давления. Величина в
правой части ур-я опред-ся темпер-ой
- парциальные давления. Величина в
правой части ур-я опред-ся темпер-ой
 – константа
равновесия. Т.О. парц-ые давления реаг-их
газов связаны м/у собой опред-ым соотн-ем.
Также можо перейти от одной связи к
другой
– константа
равновесия. Т.О. парц-ые давления реаг-их
газов связаны м/у собой опред-ым соотн-ем.
Также можо перейти от одной связи к
другой

где
 -
измен-е числа молей
-
измен-е числа молей
Если при одной и той же t газов-е смеси наход-ся нах-ся в нескольких разных сосудах под различ. давл-ем, то несмотря на то, что const равнов-я одинакова, составы смеси могут отлич-ся друг от др. Для опред-я парц-го давл-я, кроме знач-й const равновесия, надо знать состав до начала р-ции.
11.Изменение свободной энергии при химических реакциях.
А+2В=3D
При
 =0
– равновесие;
<0
– в сторону обр-я соед-я D;
>0
– диссоц-я.
=0
– равновесие;
<0
– в сторону обр-я соед-я D;
>0
– диссоц-я.
Пусть имеется
неравнов-я смесь А, В и D
с давл-ми
 .
Найдем изм-е свобод-ой эн-и при протекании
р-ции, когда А и В превращ-ся в Д при
заданном давлении.
.
Найдем изм-е свобод-ой эн-и при протекании
р-ции, когда А и В превращ-ся в Д при
заданном давлении.
 ,
,
 Допустим, что выбор-е давл-е отвечает
состоянию равнов-я, тогда
Допустим, что выбор-е давл-е отвечает
состоянию равнов-я, тогда
 – урав-е Вант-Гоффа или урав-е изотермы
хим-ой р-ции.
– урав-е Вант-Гоффа или урав-е изотермы
хим-ой р-ции.
Т.о яв-ся мерой хим-го сродства, т.е. харак-ет тенденцию в-тв, реагир-х друг с другом самопроизвольн-ми образ-ми продуктов р-ции. При рассм-и особое знач-е имеет особый случай, когда взятый в своих стандарт-ых сост-ях с образ-ем продуктов в таком же сост-и
 – стандарт-ое
сост-е свободной эн-и
– стандарт-ое
сост-е свободной эн-и
12. Изменение энергии Гиббса при изменении температуры.
 (1) Подставим
значение
(1) Подставим
значение


 (2) – урав-е изобары
хим-ой р-ции.
(2) – урав-е изобары
хим-ой р-ции.
Знак производной
опред-ся знаком теплов-го эффекта. В
случае эндотерм. р-ции

 повыш-ся при повыш-и T,
для экзотерм-ой
повыш-ся при повыш-и T,
для экзотерм-ой
 пониж-ся при пониж-и Т.
пониж-ся при пониж-и Т.
 (3) – урав-е изохоры
хим-ой р-ции.
(3) – урав-е изохоры
хим-ой р-ции.
Из (2) и (3) следует.
Что соед-я, образ-е с помощью тепла при
высоких Т-ах яв-ся более устойчивыми,
а экзот. прочны при низких Т-ах. Для
того, чтобы происх. р-ция, приняли, что
 не яв-ся ф-цией
не яв-ся ф-цией
 .
Оно может быть более-менее обусловл.,
если при измен-и теплоемк-ти при р-ции
близко к нулю. Ими рассм. очень узкий
интервал темпер-р.
.
Оно может быть более-менее обусловл.,
если при измен-и теплоемк-ти при р-ции
близко к нулю. Ими рассм. очень узкий
интервал темпер-р.
 (4)
(4)
Соот-е (4) показ-ет,
что м/у
 и обр. темпер-ой сущ-ет прямолин-я
завис-ть из кот-ой ч/з tg
угла можно найти
и обр. темпер-ой сущ-ет прямолин-я
завис-ть из кот-ой ч/з tg
угла можно найти

