
- •1.Первый закон терм-ки. Термод. Координаты, обобщенные силы.
- •2.Второй закон термодинамики. Общее понятие энтропии.
- •3.Основные условия существования термодинамического равновесия.
- •4.Химический потенциал.
- •5.Основные термодинамические потенциалы.
- •7.Термод. Потен-лы идеального газа.
- •8.Распределение в-ва м/у 2 фазами.
- •9.Фазовые превращения. Уравнения Клаузиуса – Клапейрона и Кирхгофа.
- •10.Хим. Равновесие в гом-ых сис-х.
- •11.Изменение свободной энергии при химических реакциях.
- •12. Изменение энергии Гиббса при изменении температуры.
- •15.Равновесие в гетеро-х системах.
1.Первый закон терм-ки. Термод. Координаты, обобщенные силы.
Энергия изолир. системы const. Она может изменяться за счет: 1) соверш-я работы А над окр. средой.
2) обмена теплотой Q с окр средой.
dU = δQ + δА(диф. форма)
ΔU = Q + А (инт. форма)
В отличие от внутр. энергии понятие теплоты и работы отн-ся не к системе, а к процессам. Работа – упорядоч-я форма передачи энергии, а теплота – неупоряд-я, связанная с хаотич. движением частиц.
Бесконечно малую работу можно представить как произ-ние обобщ. силы на изменение обобщ. корд-ты:
δАмех = - pdV (мех. А (А расширения))
δАпов = σdΩ (A изм-я площади пов-ти).
Значение обоб. силы не зависит от размеров системы и кол-ва вещ-ва в ней в отличие от обобщ. коорд-ты. Поэтому обобщ. силы наз-ют ИНТЕНСИВНЫМИ, а обоб. коорд. ЭКСТЕНСИВНЫМИ.
2.Второй закон термодинамики. Общее понятие энтропии.
2 з-н термодинамики:
1)термод. коорд-ты соотв-е тем-ре яв-ся некоторой ф-ей S, называемая энтропией. Энтропия яв-ся ф-ей состояния.
2)при всех процессах в природе изменение энтропии изол. системы >0 или = 0.

Если система может обмениваться энер-ей с окр. средой, то S может и ↓.
[S] = Дж/К
Для равновесных
и обратимых процессов
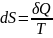
1/Т – яв-ся просто интегрирующим множителем.
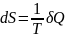
Выражая из 1 закона терм-ки δQ (dU=δQ + δA), мы получим:

3.Основные условия существования термодинамического равновесия.
ТЕРМОД. РАВНОВЕСИЕ – состояние термод.. системы, не изменяющееся во времени и не сопровождающееся переносом через систему в-ва или энергии.
Найдем условия, кот-е должны выполняться при термод. равновесии. Пусть на систему действуют только 2 пар-ра: тем-ра и давление. Тогда можно считать, что U, V, S равны их сумме по отдельным фазам:
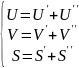 (1)
(1)
Фаза – часть термод. системы, однородное по своему макроскоп. св-ву. Различные фазы отделены друг от друга физич. пов-тями раздела, имеющими конечную толщину.
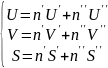 (2)
(2)
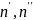 - кол-во молей
первой и второй фаз.
- кол-во молей
первой и второй фаз.
Найдем экстрем. знач-е энтропии, приравняв ее возможное знч-е к 0.
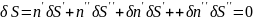 (3)
(3)
Однако, S
в дан-м случае огранич. учловием:
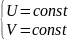 (4)
(4)
К тому же в силу з. пост-ва массы, число мол-л также const.
 (5)
(5)
Подставим в (3)

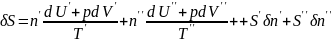 (6)
(6)
Исключим с помощью ур-я связи (5) вел-ны, относ-ся ко 2 фазе:
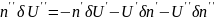 (7)
(7)
 (8)
(8)
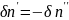 (9)
(9)
Подставим (7), (8), (9) в (6) и сгруппируем. Полученное ур-е должно выполняться при любых δU, δV, δn, если коэф. каждого из них = 0. В итоге мы получим основные усл-я терм. равновесия:
1)
2)
3)
4.Химический потенциал.
Хим. потенциал опред. по ф-ле:
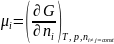
где G – свободная энергия Гиббса
Для однокомпонентного раствора: µ = G
Для многокомпонентного:
µ·N = G
Хим. пот-л характер-ет приращение
термодинам. потен-ла при изменении кол-ва данного вещ-ва и постоянстве естествен. переменных и кол-в осталь. вещ-в.
Химический потенциал зависит как от концентрации данного компонента, так и от вида и концентрации др. компонентов системы (фазы). Только в простейшем случае — смеси идеаль-х газов — µi зависит лишь от конц-ции рассмат-го компонента и от тем-ры:
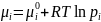
где
pi
— парц-е давление компонента i в смеси,
R — газовая постоянная,
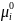 — значение
— значение
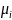 при pi
= 1 атм.
при pi
= 1 атм.
