
- •Содержание
- •1 Аналитический обзор 11
- •2 Методическая часть 29
- •3. Экспериментальная часть 37
- •4 Обсуждение результатов эксперимента 44
- •Условные обозначения
- •Введение
- •1 Аналитический обзор
- •1.1 Регулярные мультимолекулярные структуры
- •1.2 Хроматография
- •1.2.1 Металл-аффинная хроматография – сочетание принципов лигандообменной и аффинной хроматографии
- •1.3 Методы характеризации сорбентов
- •1.3.1 Удельная поверхность
- •1.3.2 Емкость сорбента, влажность
- •1.3.3 Электрокинетический потенциал
- •1.4 Maldi масс-спектрометрия
- •1.5 Идентификация белков – метод pmf
- •1.6 Тандемная масс-спектрометрия (мс-мс) и идентификация пептиов по фрагментным масс-спектрам
- •1.7 Идентификация пост-трансляционных модификаций
- •1.8 Аддукты зомана с сывороточным альбумином
- •2 Методическая часть
- •2.1 Используемые материалы:
- •2.2 Методики получения сорбента и исследования
- •2.2.1 Получение рмм (FeIii) сорбента
- •2.2.2 Определение удельной поверхности сорбента
- •2.2.3 Определение сорбционной емкости сорбента
- •2.2.3.1 Проведение металл-аффинного анализа
- •2.2.3.2 Определение влажности рмм Fe(III) сорбента
- •2.2.3.3 Определение влажности коммерческого сорбента
- •2.2.4 Анализ фосфорилированных пептидов казеина молока коровы
- •2.2.4.1 Выделение суммарного белка из обезжиренного сухого молока
- •2.2.4.2 Гидролиз суммарного белка молока коровы в присутствии трипсина
- •2.2.5 Анализ фосфонилированных пептидов сывороточного альбумина человека
- •2.2.5.1 Гидролиз сывороточного альбумина человека в присутствии пепсина
- •2.2.6 Масс-спектрометрический анализ
- •2.2.6.1 Масс-спектрометрический анализ методом maldi-tof и maldi-tof-tof
- •2.2.6.2 Обработка данных масс-спектрометрического анализа
- •3. Экспериментальная часть
- •3.1. Получение рмм Fe(III) сорбента
- •3.2 Определение удельной поверхности
- •3.3 Определение электрокинетического потенциала и размера частиц.
- •3.4 Определение сорбционной емкости сорбента
- •3.4.1Проведение металл-аффинного анализа
- •3.4.2 Определение содержание пептида в проскоке и контрольном образце
- •3.4.3 Определение влажности коммерческого сорбента и рммс Fe(III)
- •3.5 Анализ фосфорилированных пептидов казеина молока коровы
- •3.5.1 Приготовление микроколонки с сорбентом
- •3.5.2 Металл-аффинная хроматография на коммерческом сорбенте
- •3.5.3 Металл-аффинная хроматография на рммс Fe(III)
- •3.6 Анализ фосфонилированных пептидов сывороточного альбумина человека
- •3.6.1 Приготовление металл-аффинной колонки
- •3.6.2 Выбор элюэнта
- •3.6.3 Металл-аффинная хроматография на коммерческом сорбенте
- •3.6.4 Металл-аффинная хроматография на рммс Fe(III)
- •3.7 Масс-спектрометрический анализ
- •3.7.1 Проведение масс-спектрометрического анализа
- •4 Обсуждение результатов эксперимента
- •4.1 Охарактеризация сорбента
- •4.1.1. Получение рмм сорбента, содержащего ионы железа (III) и приготовление хроматографических колонок.
- •4.1.2 Определение удельной поверхности
- •4.1.3 Определение емкости сорбента
- •4.1.4 Микроэлектрофоретические исследования.
- •4.1.4.1 Определение электрокинетического потенциала
- •4.1.4.2 Расчет удельной поверхности рмм сорбента
- •4.2 Исследование возможности специфичного выделения фосфорилированных пептидов из биологического образца методом металл-аффинной хроматографии с использованием рммс(Fe III)
- •4.3 Разработка метода металл-аффинного выделения прямых ковалентных аддуктов зомана с сывороточным альбумином с помощью рмм сорбентов Fe(III) для последующего масс-спектрометрического анализа
- •4.3.1 Поиск и идентификация аддуктов сывороточного альбумина человека с зоманом
- •4.3.2 Выделение фосфонилированных пептидов сывороточного альбумина человека с использованием рммс (Fe III)
- •4.3.2 Масс-спектрометрическая идентификация сайтов связывания зомана с альбумином при взаимодействии с белками in vitro
- •Выводы по работе:
- •Список использованных источников.
- •Приложение а Технико-экономическая оценка научно-исследовательской работы Обоснование договорной цены на разработку
- •Расчет затрат на научно-исследовательскую разработку
- •Расчет затрат на сырье, материалы, реактивы, покупные изделия и полуфабрикаты
- •Расчет затрат на энергоресурсы
- •Расчет затрат на приборы, оборудование для научно-экспериментальных работ и суммы амортизационных отчислений
- •Расчет затрат на оплату труда с обязательными начислениями
- •Прочие затраты Расчет суммы расходов по использованию вычислительной техники.
- •Затраты на выполнение специальных анализов.
- •Расчет суммы накладных расходов
- •Расчет сметы затрат на разработку
- •Приложение б Охрана труда и окружающей среды
- •1 Опасные и вредные производственные факторы
- •2 Пожарная безопасность
- •3 Обеспечение санитарно-гигиенических условий
- •4 Вентиляция
- •5 Аптечка и ее содержание
- •6 Освещение помещения
- •7 Безопасность выполнения работы в лаборатории
- •8 Анализ технологических операций
- •9 Меры первой помощи
- •Охрана окружающей среды
- •Приложение в
- •Приложение г Масс-спектры смеси триптических пептидов казеина, элюированных с колонки с сорбентом, содержащим ионы железа.
4.3 Разработка метода металл-аффинного выделения прямых ковалентных аддуктов зомана с сывороточным альбумином с помощью рмм сорбентов Fe(III) для последующего масс-спектрометрического анализа
4.3.1 Поиск и идентификация аддуктов сывороточного альбумина человека с зоманом
На первом этапе работы было необходимо обнаружить аддукты фосфорсодержащего органического соединения – зомана с сывороточным альбумином человека. Опираясь на литературные данные, представленные в разделе «Аналитический обзор», а также на опыт в поиске альбуминовых аддуктов параоксона и RVX [30], можно сделать вывод, что основной мишенью присоединения остатка зомана к молекуле альбумина является тирозин 411. Кроме того, не стоит также выпускать из внимания и вторую по вероятности присоединения мишень – тирозин 150 (148). Также на основании анализа литературы [27] был сделан вывод, что при проведении анализа методом MALDI, следует с большим вниманием отнестись к выбору фермента при гидролизе альбумина и наиболее перспективным считается пепсин. Пепсин гидролизует аминокислотную последовательность по лейцину и фенилаланину. Этот фермент используют в тех случаях, когда искомые триптические пептиды обладают неудобной для анализа молекулярной массой: слишком низкой (важно при анализе методом MALDI из-за заселения низкомолекулярной области спектра матричными сигналами) или слишком высокой (важно при необходимости проведения MS/MS анализа). В представленной ниже таблице 4.3.1 указаны пептиды, полученные после проведения теоретического гидролиза пепсином аминокислотной последовательности сывороточного альбумина человека. Разница в номере аминокислоты обусловлена тем, что принято вести отсчет от первой аминокислоты в последовательности основной цепи белка, в то время как в базе данных учитывается и сигнальный пептид (18 аминокислот), и пропептид (4 аминокислоты). В таблицах среди прочего указаны расчетные молекулярные массы протонированных нативных пептидов, содержащих предположительно модифицируемую аминокислоту и расчетные молекулярные массы протонированных пептидов модифицированных остатком зомана, отличающихся от нативных на величину 162 Да.
Таблица 4.3.1 – Результаты теоретического гидролиза сывороточного альбумина человека, модифицированного остатком зомана. Пептиды, включающие в себя тирозин-411 (434).
|
МН+ нативного пептида, Да |
МН+ модифицированного пептида. Да |
Позиция пептида в аминокислотной последовательности |
Колическтво недоразрывов аминокислотной последовательности |
Аминокислотная последовательность пептида |
||
|
3678,04 |
3840,04 |
423-454 |
4 |
GEYKFQNALLVRY*TKKVPQV STPTLVEVSRNL |
||
|
3397,85 |
3559,85 |
419-447 |
5 |
FEQLGEYKFQNALLVRY*TKK VPQVSTPTL |
||
|
3250,78 |
3412,78 |
420-447 |
4 |
EQLGEYKFQNALLVRY*TKKV PQVSTPTL |
||
|
3053,75 |
3215,75 |
428-454 |
3 |
QNALLVRY*TKKVPQVSTPTL VEVSRNL |
||
|
2880,60 |
3042,60 |
423-447 |
3 |
GEYKFQNALLVRY*TKKVPQV STPTL |
||
|
2627,52 |
2789,52 |
432-454 |
2 |
LVRY*TKKVPQVSTPTLVEVS RNL |
||
|
2514,44 |
2676,44 |
433-454 |
1 |
VRY*TKKVPQVSTPTLVEVSR NL |
||
|
2256,31 |
2418,31 |
428-447 |
2 |
QNALLVRY*TKKVPQVSTPTL |
||
|
1830,08 |
1992,08 |
432-447 |
1 |
LVRY*TKKVPQVSTPTL |
||
|
1717.00 |
1879 |
433-447 |
0 |
VRY*TKKVPQVSTPTL |
||
На основании анализа аминокислотных последовательностей возможно модифицированных пептидов можно сделать выводы, что фермент пепсин может дать положительные результаты при поиске аддуктов зомана с альбумином. Поэтому был проведен ферментативный гидролиз образца сывороточного альбумина человека, модифицированного остатком зомана, выделенного из предварительно осажденной для удаления избытка зомана и перерастворенной донорской плазмы крови человека. Концентрация зомана составляла 0.1 мг/мл, высокая концентрация зомана обусловлена необходимостью наработки высокой концентрации аддукта для получения возможности провести весь спектр исследований, включающий идентификацию.
Параллельно для сравнения также был проведен ферментативный гидролиз контрольного сывороточного альбумина человека, не содержащего модификацию и выделенного тем же способом. Далее все гидролизаты были проанализированы методом MALDI-TOF, и результаты сравнивали как с полученными теоретическими таблицами, так и с масс-спектром гидролизата контрольного образца.
Результат масс-спектрометрического анализа пептического гидролизата сывороточного альбумина человека представлен на рисунке 4.3.1.1. Идентификация белка была проведена методом PMF с помощью программы Mascot для достижения следующих целей: 1 – проверка качества выделенного белка; 2 – проверка полноты прохождения гидролиза; 3- определение области поиска аддуктов (по результатам проверки полноты прохождения гидролиза). Белок был идентифицирован, как сывороточный альбумин человека.
Как показано на рисунке даже при первичной обработке в масс-спектре надежно детектируется сигнал с МН+ 1992,11 Да (рисунок 4.3.1.1 в), который можно отнести к пептиду LVRYTKKVPQVSTPTL, содержащему тирозин-411, модифицированному остатком зомана. Кроме того, следует отметить, что в масс-спектрах контрольных образцов указанный сигнал не детектируется.
Особого внимания заслуживают еще два сигнала, которые наблюдаются в масс-спектре модифицированного образца и отсутствуют в контрольных, а именно, сигналы с МН+ 1568,84 Да и 1680,76 Да (рисунок 4.3.1.1а, б). Несмотря на то, что их не получилось отнести к уже известным нам модификациям, каждый из них имеет предшественника с массой, отличающейся на 162 Да, и содержащего треонин.
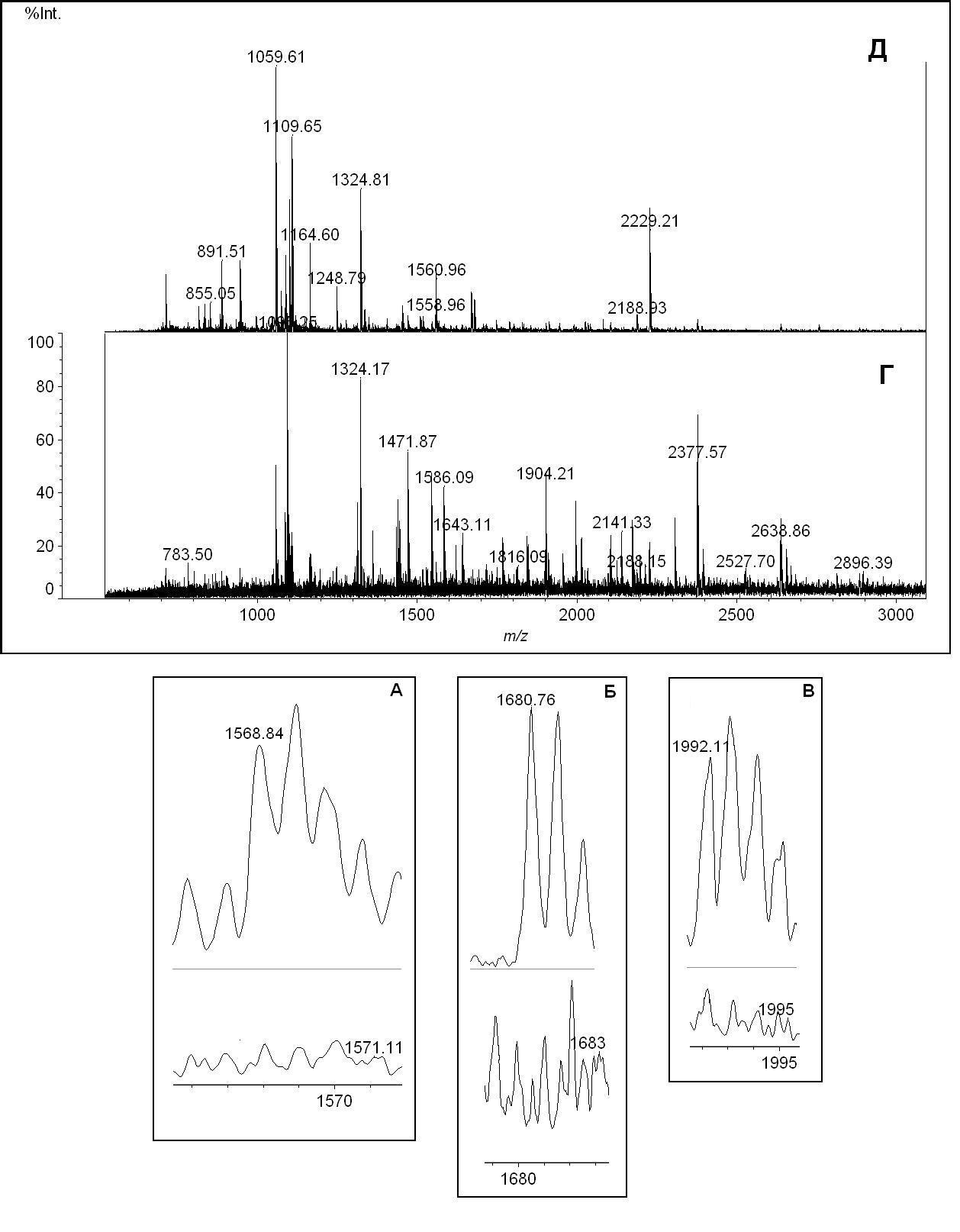
А – область масс, соответствующая возможному аддукту с МН+ 1568,84 Да; Б – область масс, соответствующая возможному аддукту с МН+ 1680,76 Да; В – область масс, соответствующая аддукту LVRYGDTKKVPQVSTPTL. На вкладках верх – модифицированный образец, низ – контроль. Г – общий масс-спектр модифицированного образца; Д – общий масс-спектр контрольного образца.
Рисунок 4.3.1.1 – MALDI масс-спектр пептического гидролизата сывороточного альбумина человека, модифицированного зоманом
Таким образом, были обнаружены следующие аддукты сывороточного альбумина человека с зоманом:
Пептические пептиды:
-
МН+ 1992,08 Да LVRYGDTKKVPQVSTPTL (рисунок 3.3.1.1 В),
-
МН+ 1680,79 Да HTLFGDKLCTVATL(GD) (рисунок 3.3.1.1 Б),
-
МН+ 1568,84 Да VKHKPKATKEQL(GD) (рисунок 3.3.1.1 А).
Для каждого из этих пептидов был получен фрагментный масс-спектр, представленный на рисунке 4.3.1.2. К сожалению, метод фрагментации, реализованный в масс-спектрометре Axima Performance Shimadzu (CID) является достаточно жестким, и зачастую не позволяет проводить фрагментацию пептидов, содержащих сложные модификации без их потерь. Тем не менее, по результатам МС-МС анализа можно сделать однозначный вывод, что все сигналы принадлежат пептидам, модифицированным остатком зомана: при фрагментации пептиды теряют частицу с массой 162 Да, что соответствует массе остатка GD, также наблюдается сигнал, свидетельствующий о деструкции остатка зомана до остатка метилфосфоновой кислоты. Это однозначно доказывает наличие модификации на пептиде.

1 – VKHKPKATKEQL(GD); 2 – HTLFGDKLCTVATL(GD); 3 –LVRYGDTKKVPQVSTPTL
Рисунок 4.3.1.2– Фрагментный масс-спектр пептических пептидов сывороточного альбумина человека, модифицированных зоманом
Следующим этапом было необходимо удостовериться, при каких концентрациях зомана возможно масс-спектрометрическое детектирование аддуктов. Для этого использовали образцы, содержащие сывороточный альбумин человека, инкубированный с зоманом в концентрациях 0.1мг/мл, 10-2 мг/мл, 10-3 мг/мл, 10-4мг/мл, 10-5мг/мл, 10-6мг/мл, 10-7мг/мл.
Все образцы были подвергнуты ферментативному гидролизу в присутствии пепсина, а гидролизаты проанализированы методом MALDI-TOF. На рисунке 4.3.1.3 представлены масс-спектры образцов в порядке понижения концентрации зомана до концентрации 10-7 мг/мл при инкубации с белком.
Как видно из данных масс-спектров во всех экспериментальных образцах присутствуют сигналы, принадлежащие, возможно, модифицированным пептидам альбумина человека: 1568 Да, 1680 Да, 1992 Да. Сигнал с МН+ 1568 Да наблюдается в образцах с концентрацией зомана равной 0.1мг/мл, 10-2 мг/мл, 10-3мг/мл, 10-4мг/мл. При более низком содержании зомана при инкубации, в масс-спектрах сигнал с данной массой не наблюдается. Сигнал с МН+ 1680 Да детектируется только при высоких концентрациях зомана, т.е. 0.1мг/мл, 10-2 мг/мл. В то время как сигнал с МН+ 1992 Да наблюдается во всех масс-спектрах экспериментальных образцов. Для проверки был проведен MS/MS анализ всех трех пептидов, и только в одном случае, а именно при фрагментации пептида, которому соответствует МН+ 1992 Да не были обнаружены сигналы, соответствующие отщеплению остатка зомана от пептида (рисунок 4.3.1.4). Таким образом, наличие данного сигнала (без подтверждения тандемной масс-спектрометрией) в масс-спектрах образцов может дать ложноположительный результат. После оценки наличия сигналов интересующих нас аддуктов в масс-спектрах, эти образцы были использованы для отработки метода выделения фосфонилированных пептидов с помощью металл-аффинной хроматографии.

Рисунок 4.3.1.3 – Масс-спектры пепсиновых гидролизатов альбумина человека, модифицированного зоманом в различных концентрациях. 1 – GD 0.1мг/мл, 2 – GD 10-2 мг/мл, 3 – GD 10-3мг/мл, 4 – GD 10-4мг/мл, 5 – GD 10-5мг/мл, 6 – GD 10-6мг/мл, 7 – GD 10-7мг/мл

Рисунок 4.3.1.4 – Фрагментный масс-спектр пептида в плазме крови человека с МН+ 1992 Да, не содержащего модификацию зоманом
