
Экзаменационный билет № 24
-
Гидролиз солей. Простой (обратимый) и сложный (необратимый) гидролиз (примеры).
-
Понятие о. Свободная поверхностная энергия.
Ответ:
Гидролиз солей.
Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей.
Различают несколько вариантов гидролиза солей:
-
1. Гидролиз соли слабой кислоты и сильного основания:
Na2CO3 + Н2О = NaHCO3 + NaOH
CO32- + H2O = HCO3- + OН-
(раствор имеет щелочную среду, реакция протекает обратимо)
-
2. Гидролиз соли сильной кислоты и слабого основания:
СuСl2 + Н2О = CuOHCl + HCl
Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет кислую среду, реакция протекает обратимо)
-
3. Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OН)3 + 3H2S
2Аl3+ + 3S2- + 6Н2О = 2Аl(OН)3(осадок) + ЗН2S(газ)
(Гидролиз в этом случае протекает практически полностью, так как оба продукта гидролиза уходят из сферы реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и имеет нейтральную среду.
Коллоидные системы (коллоиды, др.-греч. κόλλα — клей и εἶδος — вид) — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями и эмульсиями.
Размеры коллоидных частиц варьируются в пределах от 10-7 до 10-5 см. В свободнодисперсных коллоидных системах (дымы, золи) частицы не выпадают в осадок.
Основные свойства
-
Коллоидные частицы не препятствуют прохождению света.
-
В прозрачных коллоидах наблюдается рассеивание светового луча (эффект Тиндаля).
-
Дисперсные частицы не выпадают в осадок за счёт броуновского движения.
Основные виды
-
дым — взвесь твёрдых частиц в газе.
-
туман — взвесь жидких частиц в газе.
-
суспензия — взвесь твёрдых частиц в жидкости.
-
эмульсия — раствор жидкости в жидкости.
-
пена — раствор газа в жидкости или твёрдом теле.
-
гель — раствор жидкости в твёрдом теле.
-
сплав — раствор твёрдого тела в твёрдом теле.
Коллоидные системы, применяемые в химическом анализе
Из коллоидных систем наибольшее значение для химического анализа имеют гидрозоли — двухфазные микрогетерогенные дисперсные системы, характеризующиеся предельно высокой дисперсностью, в которых дисперсионной средой является вода — наиболее часто применяемый в аналитической практике растворитель. Встречаются также органозоли, в которых дисперсионной средой являются неводные (органические) растворители. В результате молекулярного сцепления частиц дисперсной фазы из золей при их коагуляции образуются гели. При этом не происходит разделения фаз; другими словами, переход золей в гель не является фазовым превращением.
При образовании геля вся дисперсионная среда (например, вода в гидрозоле) прочно связывается поверхностью частиц дисперсной фазы и в ячейках пространственной структуры геля. Гели способны обратимо восстанавливать свою пространственную структуру во времени, но после высушивания наступает разрушение их структуры и они теряют эту способность.
Поверхностная энергия
ПОВЕРХНОСТНАЯ ЭНЕРГИЯ
энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объеме
Поверхностная энергия связана с межмолекулярным взаимодействием, т.к. состояние частиц (атомов, молекул) на границе раздела фаз отличается от состояния в объеме фаз вследствие нескомпен-сированности силовых полей частиц на пов-сти раздела.
Обычно, говоря о поверхностной энергии, имеют в виду уд. свободную поверхностную энергию s. С ростом т-ры вдали от критич. точки s линейно уменых ается, тогда как e практически от т-ры не зависит. При приближении к критич. точке различие в св-вах контактирующих фаз сглаживается и поверхностная энергия обращается в нуль
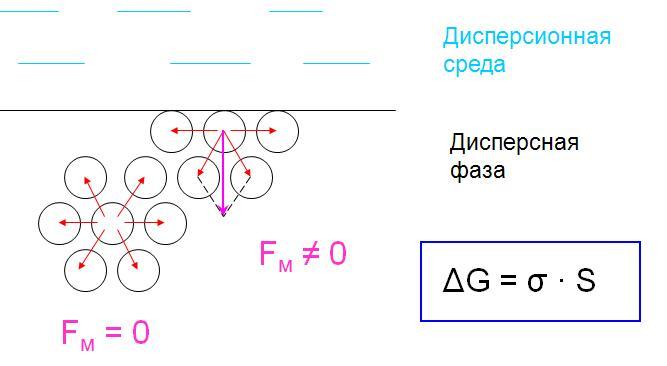
ΔG – свободная поверхностная энергия (энергия Гиббса образования поверхности, Дж)
S – площадь поверхности раздела фаз (м2)
σ – удельная поверхностная энергия (Дж/м2)
