
Экзаменационный билет № 22
-
Изменение энтальпии системы как энергетический критерий направления протекания процесса. Термохимия. Закон Гесса и следствия из него.
-
Катодная защита металлов от коррозии: электрозащита и протекторная защита.
∆Энтальпия хим. реакции – тепловой эффект реакции, измеренный при постоянном давлении. Обозначается ∆Н. В экзотермической реакции теплота выделяется, энтальпия системы уменьшается и ∆Н < 0, в эндотермической реакции энтальпия системы повышается и ∆Н > 0.
Т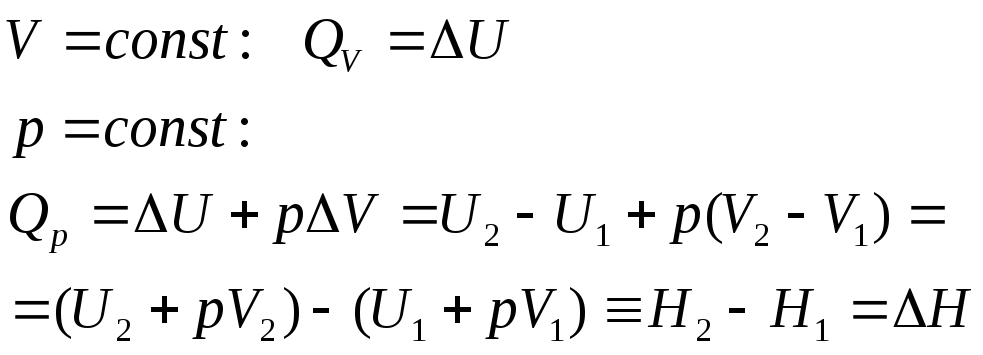 епловой
эффект реакции-
теплота, выделяющаяся или поглощающаяся
при химической реакции.
епловой
эффект реакции-
теплота, выделяющаяся или поглощающаяся
при химической реакции.
Э![]() нтальпия
системы связана с внутренней энергией
соотношением ( U
– внутрееняя энергия)
нтальпия
системы связана с внутренней энергией
соотношением ( U
– внутрееняя энергия)
![]()
Закон Гесса
Тепловой эффект реакции зависит только от начального и конечного состоянийвеществ и не зависит от пути перехода

С(графит) + О2(г) = СО2(г); ΔН1 =-393,5 кДж
С(графит) + 1/2О2(г) = СО(г); ΔН2 = -110,5 кДж
СО(г) + 1/2О2(г) = СО2(г); ΔН3 = -283,0 кДж
ΔН1= ΔН2 + ΔН3 = -393,5 кДж-393,5 кДж
Следствия из закона Гесса
Закон Лавуазье-Лапласа. Тепловой эффект обратной реакции равен тепловому эффекту прямой реакции с обратным знаком
![]()
![]()
Т![]() епловой
эффект реакции ΔrH
равен сумме теплот образования конечных
продуктов реакции за вычетом суммы
теплот образования исходных веществ.
епловой
эффект реакции ΔrH
равен сумме теплот образования конечных
продуктов реакции за вычетом суммы
теплот образования исходных веществ.
Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Катодная защита – металл соединяют с отрицательным полюсом источника тока (катодом).

Протекторная защита – к изделию присоединяют металл с более отрицательным потенциалом (Zn, Mg, Al).
Экзаменационный билет № 23
-
Применение законов Рауля и Вант-Гоффа к растворам электролитов. Изотонический коэффициент, его связь со степенью диссоциации.
-
Легирование как способ защиты металлов от коррозии. Жаростойкость и жаропрочность.
Ответ:
По Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде Р=СRT
Так как объем одного моля газообразного вещества при нормальных условиях равен 22,4 литра, то осмотическое давление раствора, содержащего 1 моль вещества, равно 22,4 атм.
Измерение осмотического давления раствора используется для определения молекулярных масс даже разбавленных растворов, что позволяет оценивать молекулярные массы растворимых высокомолекулярных соединений, в частности, биополимеров. Заменив C(B) в формуле Вант-Гоффа соотношением (m(B) • 1000 / M(B) • V), получим уравнение, позволяющее вычислять молекулярные массы растворенных веществ: Pocm= (m/M*V) *RT
m(B) – масса растворенного вещества, V – объем раствора.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворенного вещества, изотоничность является следствием одинакового числа частиц в растворе.
Поскольку при растворении реальное число частиц может отличаться от числа растворенных молекул, Вант-Гофф ввел понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворенных молекул. Показывает во сколько раз осмотическое давление данного раствора больше нормального P= iCRT
В бензольном растворе уксусной кислоты i < 1, ибо в этом растворе число частиц меньше числа молекул, в результате реакции ассоциации
Если же в растворе преобладает не ассоциативный, а диссоциативный или ионизационный механизмы взаимодействия, то i > 1. Так, в водном растворе уксусная кислота диссоциирует CH3COOH = CH3COO– + H+, и число частиц становится больше числа молекул.
Первый закон Рауля – парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества: ∆р= рn/N где р- давление пара чистого растворитля, ∆р- понижение давления пара, N- число моль растворителя.
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:
∆t= KC где К- криоскопическая или эбуллиоскопическая константа, С- число моль растворенного вещества на 1000 г. Растворителя.
Коррозией (от лат. соггоАеге — разъедать) называется самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды. Ежегодно из-за коррозии теряется около четверти всего произведенного в мире железа. Однако не только потеря металлов, но и порча изготовленных из них изделий обходится очень дорого. Затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов и коммуникаций во много раз превышают стоимость металла, из которого они изготовлены.
Коррозия вызывает серьезные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно воздействует на здоровье и жизнь людей. Понятно, почему на защиту металлов и сплавов от коррозии тратятся большие средства.
ЛЕГИРОВАНИЕ (нем. legieren — сплавлять, от лат. ligo — связываю, соединяю), 1) введение в состав металлических сплавов т. н. легирующих элементов (напр., в сталь — Cr, Ni, Mo, W, V, Nb, Ti и др.) для придания сплавам определенных физических, химических или механических свойств. 2) Введение примесных атомов в твердое тело (напр., в полупроводники для создания требуемой электрической проводимости). Легирование диэлектриков обычно называют активированием. ЖАРОУПОРНОСТЬ (жаростойкость, окалиностойкость), способность металлических материалов противостоять химическому разрушению поверхности под действием воздуха или др. окислительной газовой среды при высоких температурах. ЖАРОПРОЧНОСТЬ, способность конструкционных материалов (главным образом, металлических) выдерживать без существенных деформаций механические нагрузки при высоких температурах. Определяется комплексом свойств: сопротивлением ползучести, длительной прочностью и жаростойкостью.
